微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X为主族元素,其原子最外层只有一个电子,Y元素的最高正价与负价的代数和为0,Z元素原子的最外层电子数是次外层的3倍,则X、Y、Z形成的化合物的化学式不可能是
[? ]
A.X2Z2?
B.X4YZ4
C.X2Y2Z4?
D.X5Y2
参考答案:D
本题解析:
本题难度:一般
2、填空题 现有四种短周期元素X、Y、Z、W,其中:
① X、W原子的电子层数与最外层电子数之比分别为3:1和1:3
② Y元素的某原子核内无中子
③ Z元素原子的最外层电子数是其内层电子总数的2倍。
回答下列问题:
(1)X元素在周期表中的位置是__________________。
(2)上述四种元素中,只由一种元素的原子构成的常见离子是_______________(填离子符号)。
(3)化合物X2W2的电子式是___________________。
(4) 向含1mol Na2SiO3的溶液中缓慢通入2mol的ZO2,反应的离子方程式是______________________。
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是______________(填化学式)。
(6)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向25.00 mL 的Y2Z2W4溶液中加入5.00 mL 0.50 mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是____________mol/L。
参考答案:(1)第三周期、第ⅠA族
(2)Na+、H+、O2-、O22-、C22-
(3)?
(4)2CO2+2H2O+SiO32-==2HCO3-+H2SiO3↓?
(5)H2O2、CH4O、C2H6
(6)0.25
本题解析:
本题难度:一般
3、选择题 随着卤素原子半径的增大,下列递变规律正确的是
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强
D.单质的氧化性逐渐增强
参考答案:B
本题解析:卤族元素随着原子序数的递增,其性质呈现规律性的变化,由于相对分子质量的增大,单质的熔沸点逐渐升高,常温下F2、Cl2为气态,Br2为液态,碘为固态;单质的氧化性逐渐减弱,对应的卤离子的还原性逐渐增强;气态氢化物的稳定性也逐渐减弱,它们水溶液的酸性却逐渐增强(在相同条件下).
本题难度:困难
4、选择题 下列有关推断中不符合实际的是( )
A.第n周期第n主族的元素不一定是非金属元素
B.第n周期第n主族(n>1)的元素一定是金属元素
C.第n周期有(8-n)种非金属元素(n>1,包括稀有气体元素)
D.第n周期中有2n2种元素
参考答案:A.第一周期第ⅠA族的元素为H,属于非金属元素,第三周期ⅢA元素为Al,属于金属元素,故A正确;
B.除第一周期外,由元素在周期表位置可知,第n周期第n主族的元素为金属元素,故B正确;
C.第二周期含有6种非金属元素,第三周期含有5种非金属元素,第四周期含有4种非金属元素,第五周期含有3种非金属元素,第六周期含有2种非金属元素,第七周期含有1种非金属元素,则第n周期有(8-n)种非金属元素(n>1,包括稀有气体元素),故C正确;
D.第三周期中含有8种元素,长周期中都不符合第n周期中有2n2种元素,故D错误;
故选D.
本题解析:
本题难度:一般
5、简答题 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)H元素在周期表中的位置为:______.
(2)D的氢化物比G的氢化物稳定,其原因是______.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为______;该物质的水溶液中滴入酚酞后,溶液显______?色.
(4)用元素符号表示出D、E、F、G的原子半径由大到小顺序:______;
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,同时为航天员提供需要的气体,请你用化学方程式表示吸收原理:______;
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______.
参考答案:根据元素在周期表中的分布知识,可以确定A是H,C是Na,B是He,D是C,E是N,F是O,G是Si,H是Cl.
(1)Cl元素在周期表中的位置为第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)同主族元素的原子从上到下原子的得电子能力越来越弱,所以C原子得电子能力比Si强,原子的得电子能力越强则形成的氢化物的稳定性越强,故甲烷稳定性强于硅烷,故答案为:D原子得电子能力比G强;
(3)氨气氢原子和氮原子之间通过共价键形成的共价化合物,电子式为
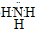
,氨气极易溶于水,它的水溶液氨水显碱性,能使酚酞溶液变红色,故答案为:
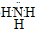
;红;
(4)Si的电子层多半径最大,C、N、O电子层一样,核电荷数越多半径越小,即C>N>O,故答案为:Si>C>N>O;
(5)过氧化钠和二氧化碳反应生成氧气,为稀释氧气,制造一种适合宇航员生存的人工生态环境,可以在飞船中加氮气,制造类似空气的环境,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;N2.
本题解析:
本题难度:一般