|
高考化学试题《化学反应速率》试题特训(2017年最新版)(十)
2017-03-03 00:21:50
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 100 mL 6 mol·L-1 H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量
A.醋酸钠溶液
B.NaCl固体
C.硫酸铜溶液
D.硝酸钠溶液
|
参考答案:A
本题解析:由于Zn过量,所以产生的氢气的量按照酸来计算。A.加入醋酸钠溶液,硫酸变为弱酸醋酸,溶液中的c(H+)减小,反应速率减小,当c(H+)减小到一定程度,醋酸会电离产生H+,最终完全电离出来,因此既减缓反应进行的速率,又不影响生成H2的总量,正确;B.NaCl固体,溶液中c(H+)不变,反应速率也不变,错误;C.硫酸铜溶液,会发生反应:Zn+Cu2+=Zn2++Cu,Cu、Zn及硫酸构成原电池,反应速率大大加快,错误;D.加入硝酸钠溶液,在酸性条件下NO3-与金属发生反应,不能产生氢气,反应原理改变,错误。
考点:考查外界条件对化学反应速率的影响的知识。
本题难度:一般
2、填空题 (11分)
(1)在一密闭的2 L的容器里充入8 mol SO2和4 mol18O2,在一定条件下开始反应:
2SO2(g)+O2(g)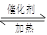 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答: 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
①反应后18O原子存在于哪些物质中________
②2 min末SO3的浓度为________
③用O2的浓度变化表示该时间段内的化学反应速率为________
(2)基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
①可以用来鉴别苯蒸气和乙烯的试剂是________(填序号)
A.水? B.溴的四氯化碳溶液? C.酸性高锰酸钾溶液? D.氢气
②苯分子具有平面正六边形结构,所有原子共平面,则苯分子中在一条直线上的原子最多有________个
(3)下列营养物质在人体内发生的变化及其对人的生命活动所起的作用不正确的是
A.人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量
B.淀粉和纤维素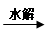 葡萄糖 葡萄糖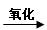 ?CO2和H2O(释放能量维持生命活动) ?CO2和H2O(释放能量维持生命活动)
C.油脂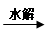 甘油和高级脂肪酸 甘油和高级脂肪酸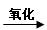 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动)
D.蛋白质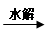 氨基酸 氨基酸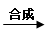 人体所需的蛋白质(人体生长发育、新陈代谢) 人体所需的蛋白质(人体生长发育、新陈代谢)
参考答案:(11分)
(1)①? SO2?O2?SO3?(1分)
②? 0.4 mol/L?(单位不写扣1分)?(2分)?
③? 0.1 mol/(L?min)?(单位不写扣1分)?(2分)
(2)①? BC?(2分) ?
②? 4?(2分)?
(3)? B?(2分)
本题解析:(1)①该反应为可逆反应,SO2中会有18O原子
②2 min末测得容器中有7.2 mol SO2,0.8 mol SO2转化成0.8 mol SO3,浓度为0.4 mol/L
③2 min 0.8 mol SO2转化成0.8 mol SO3,0.4 mol O2 转化,除以容器容积,除以时间,得到
0.1 mol/(L?min)
(2)①酸性高锰酸钾溶液 :使酸性高锰酸钾溶液褪色的是乙烯。分层后,油状物在上层的是苯,油状物在下层的是四氯化碳 ;溴水的四氯化碳溶液 :使溴水褪色的是乙烯。分层后,下层有色的是四氯化碳,上层有色的是苯。
本题难度:一般
3、选择题 将A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g) 2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物B浓度的减少来表示该反应的速率为(?) 2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物B浓度的减少来表示该反应的速率为(?)
A.0.025 mol·L-1·s-1
B.0.012 5 mol·L-1·s-1
C.0.05 mol·L-1·s-1
D.0.1 mol·L-1·s-1
参考答案:B
本题解析:Δn(B)=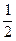 Δn(C)= Δn(C)= 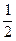 ×0.2 mol="0.1" mol, ×0.2 mol="0.1" mol,
v(B)=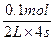 ?="0.0125" mol·L-1·s-1。 ?="0.0125" mol·L-1·s-1。
本题难度:简单
4、简答题 Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2mol?N2?3mol?H2经过10s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.容器乙起始投入a?mol?N2,b?mol?H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2mol.两平衡温度相同、相同组分的体积分数都相同.
(1)容器甲10s?内用H2表示的平均反应速率v(H2)=______,达平衡时N2的转化率=______.
(2)下列哪些情况表明容器乙已达平衡状态?______
A.容器乙的气体密度不再变化?B.氢元素的质量不再变化
C.氮气的生成速率等于氨气的消耗速率?D.断裂1molN≡N键同时断裂6mol?N-H键
(3)达平衡时甲容器的压强______?乙容器的压强(填“等于”、“大于”或“小于”).
(4)a=______mol,b=______mol.
(5)达平衡时乙容器的体积为______L.
(6)起始时容器乙是容器甲压强的______倍.
参考答案:(1)v(NH3)=△c(NH3)△t=0.8mol/5L10s=0.016mol/(L?s)
? v(H2)=32v(NH3)=32×0.016mol/(L?s)=0.024?mol/(L?s)
? α(N2)=12×0.8mol2mol×100%=20%
故答案为:0.024?mol/(L?s)? 20%
(2)A:恒温、恒压下对于反应 N2+3H2=2NH3,气体的物质的量发生变化,容器乙的体积亦随之变化,反应混合物的总质量不变.当容器乙的气体密度不再变化,说明容器乙的体积不再变化,反应到达平衡状态.故A对.
B:氢元素的质量自始至终都不发生变化,不能说明到达平衡状态.故B错.
C:利用速率相等判断是否到达平衡状态,是指同一物质的生成速率与消耗速率相等,氨气的消耗说明氮气生成,方向一致,不能说明到达平衡状态.故C错.
D:反应断裂1mol?N≡N键同时要生成6molN-H键,断裂N-H键与生成N-H键的量相等,到达平衡状态.故D对.
?故选:A?D
(3)根据理想气体状态方程:PV=nRT,得P=nVRT,由两平衡温度相同、相同组分的体积分数都相同,得nV相同,T相同,所以得出P相同.
所以本题答案为:相等
(4)I中:N2 +3H2 =2NH3
? 开始?2mol? 3mol? 0mol
? 变化? 0.4mol? 1.2mol? 0.8mol
? 平衡? 1.6mol? 1.8mol? 0.8mol
平衡时N2体积分数:1.6mol1.6mol+1.8mol+0.8mol=821
平衡时H2体积分数:1.8mol1.6mol+1.8mol+0.8mol=37
平衡时NH3体积分数:1-821-37=421
II中:容器乙中反应混合物总物质的量为:n总=1.2mol÷421=6.3mol
? N2 +3H2 ═2NH3
? 开始? ?amol? bmol?0mol
? 变化?0.6mol? 1.8mol? 1.2mol
? 平衡?(a-0.6)mol?(b-1.8)mol?1.2mol
所以:(a-0.6)mol=6.3mol×821? 得a=3
? (b-1.8)mol=6.3mol×37? 得b=4.5
故答案为:3? 4.5
(5)I中平衡时N2浓度:c(N2)=1.6mol5L
I中平衡时H2浓度:c(H2)=1.8mol5L
I中平衡时NH3浓度:c(NH3)=0.8mol5L
该温度下平衡常数kc=(0.85)2(1.85)3×1.65=101.83,平衡常数只受温度影响,温度相同平衡常数相等.
令达平衡时乙容器的体积为VL,则:(1.2v)2(2.7v)3×2.4v=101.83,得V=7.5
故答案为:7.5
(6)令起始时容器甲压强为p,起始时容器乙压强p′,由理想气体状态方程PV=nRT得:
p×5=5RT,p′×7.5=6.3RT.所以p′=0.84p
故答案为:0.84
本题解析:
本题难度:一般
5、选择题 下列说法正确的是(?)
A.活化分子之间的碰撞一定是有效碰撞
B.升高温度时,活化分子百分数增加
C.反应物分子的每次碰撞都能发生化学反应
D.有气体参加的化学反应,增大压强,反应速率增大
参考答案:B
本题解析:活化分子之间发生的碰撞不一定都是有效的,选项A不正确。同样反应物分子的每次碰撞也不一定都能发生化学反应,选项C不正确;选项D不正确,因为压强增大,但物质的浓度不一定是增大的,所以正确的答案选B。
本题难度:简单
|