|
|
|
高中化学知识点归纳《物质的量》试题强化练习(2017年最新版)(三)
2017-03-03 00:23:27
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA
B.78g过氧化钠中含阴离子数为2 NA
C.C2H4和N2组成的42g混合气体中原子的个数为3 NA
D.5NH4 NO3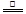 2HNO3+4N2↑+ 9H2O反应中,生成28gN2时,转移的电子数目为3.75NA 2HNO3+4N2↑+ 9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
|
2、选择题 设NA表示阿伏加德罗常数,下列说法正确的是

A.标准状况下1molHCl与HF的混合物的体积约为22.4L
B.N60结构如右图,28gN60单质中含有的N-N键个数为NA
C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失
去的结晶水数目为0.015NA
D.9 g重水所含有的电子数为5NA
3、计算题 (8分)32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.请回答:(不要求写计算过程)
(1)写出铜与稀硝酸反应的化学方程式
(2)NO为 mol.标准状况V(NO):V(NO2)=
(3)原硝酸溶液的浓度为 mol?L-1
(4)试描述实验过程中试管内产生气体现象
4、实验题 实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需仪器除了玻璃棒、烧杯、胶头滴管、量筒外,还需要哪个仪器才能完成该实验,请写出:?。
(2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(4)下列对容量瓶及其使用方法的描述中正确的是_____。
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线
1~2 cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
|
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中。
③转移前,容量瓶中含有少量蒸馏水。
④定容时,仰视刻度线。
5、填空题 现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol。则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数为______个。
(3)该气体在标准状况下的体积为______L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为______。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______mol/L