微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学原理表述正确的是
[? ]
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(?Na+)==2c(CO32-)+2c(HCO3-?)+2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-?+H2O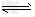 CO32-?+H3O+
CO32-?+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速度快,生成H2的物质的量多
参考答案:B
本题解析:
本题难度:一般
2、填空题 (1)FeCl3的水溶液呈______(填“酸”、“中”、“碱”)性,常温时的pH______7(填“>”、“=”、“<”),原因是(用离子方程式表示):______;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”、“抑制”)其水解.
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______.
参考答案:(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+2H+;抑制;
(2)硫化钠为强碱弱酸盐,硫离子水解而使其溶液呈碱性,水解离子方程式为S2-+H2O?HS-+OH-,在配制硫化钠溶液时,为防止其水解,可以加入少量NaOH,
故答案为:NaOH.
本题解析:
本题难度:一般
3、选择题 某醋酸溶液与0.01mol?L-1NaOH溶液等体积混合(忽略溶液体积变化),混合后溶液显碱性.下列有关叙述不可能出现的是( ? )
A.混合后溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
B.该醋酸溶液中:c(H+)=0.01?mol?L-1
C.该醋酸溶液的物质的量浓度大于0.01?mol?L-1
D.混合溶液中:c(CH3COO-)>c(Na+)
参考答案:BD
本题解析:
本题难度:一般
4、填空题 回答下列各小题:
(1)已知 在水中的电离方程式为
在水中的电离方程式为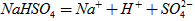 。在
。在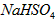 溶液
溶液
__________ (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
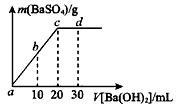
(2)常温下,向1.0mol/L的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”),c点所示的离子方程式为___________________。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”),c点所示的离子方程式为___________________。
(3)在T℃时,将 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将
__________25℃(填“高于”或“低于”),Kw为________,在该溶液中由水电离出的 为
为
_________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的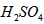 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为_________________________。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为_________________________。
(4)0.1 mol·L-1pH为4的NaHB溶液中 由大到小的顺序为
由大到小的顺序为
_______________。
(5)在0.1 mol·L-1的① 溶液、②
溶液、②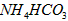 溶液、③
溶液、③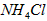 溶液中,
溶液中, 由大到小的排列顺序为_____________________。
由大到小的排列顺序为_____________________。
参考答案:(1)=
(2)中性;
(3)高于;10-12;10-10;9:11;
(4)②>③>①
(5)①>③>④>②
本题解析:
本题难度:困难
5、选择题 25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
参考答案:C
本题解析:
本题难度:一般