微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)依据氧化还原反应:2Ag+(aq)?+?Cu(s)?==?Cu2+ (aq)?+?2Ag(s)设计的原电池如图所示。

请回答下列问题: ?
①电极X的材料是__________;电解质溶液Y 是__________;
②银电极为电池的___________极,发生的电极反应式为________;X电极上发生的电极反应式为___________;
③外电路中的电子是从__________电极流向___________电极。
(2)物质Z是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
①若Z为氧化物,X的化学式是___________________________。
②若Z为单质,Z与NaOH溶液反应的离子方程式为_________________________。
③若Z与稀硫酸反应生成无色没有气味的气体A,与氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。 ?Z与稀硫酸反应的离子方程式是______________________________________; ?Z与足量氢氧化钠溶液加热的离子方程式是__________________________。
参考答案:(1)①铜?;AgNO3溶液、
②正?;Ag++e-=Ag?,Cu-2e-=Cu2+?
③铜?;银
(2)①Al2O3?
②2Al+2H2O+2OH-?==2AlO2-?+3?H2?↑
③?HCO3-?+?H+?==?CO2↑?+?H2O?;?NH4+?+?HCO3-?+2OH-?==NH3↑?+?2H2O?+?CO32-
本题解析:
本题难度:一般
2、选择题 关于原电池的叙述中正确的是?
A.构成原电池的电极是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.原电池负极发生的电极反应是还原反应
D.原电池的正极是还原剂,总是溶液中的阳 离子在此被还原
离子在此被还原
参考答案:B
本题解析:略
本题难度:简单
3、选择题 为了使反应2HCl+2Ag=2AgCl+H2↑能顺利进行,某同学设计了下列四个实验,如图所示,你认为可行的是( )
A.
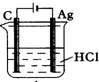
B.
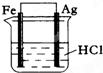
C.

D.
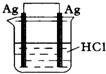
参考答案:C
本题解析:
本题难度:简单
4、计算题 按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: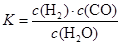
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
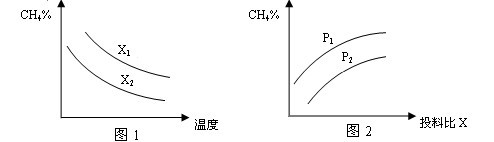
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va
参考答案:
本题解析:
本题难度:困难
5、选择题 把a、b、c、d四块金属板浸入稀硫酸中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c溶解;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡。则四块金属的活动顺序是(?)
A.a>c>d>b
B.c>a>b>d
C.a>c>b>d
D.c>a>d>b
参考答案:A
本题解析:考查金属性强弱比较和原电池的应用。原电池中较活泼的金属作负极,不活泼的金属作正极。a、b相连时,a为负极,则a>b。c、d相连时,c溶解,则c是负极,c>d。;a、c相连时,c极上产生大量气泡,则a是负极,所以a>c。b、d相连时,b极上有大量气泡,则d是负极,所以d>b。因此金属的活动顺序是a>c>d>b,答案选A。
本题难度:一般