微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X基态原子的核外电子分布在3 个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题。
(1)微粒XZ32-的中心原子杂化类型为?化合物YW3的空间构型为?。
(2)R基态原子的电子排布式为?,元素X、Y、Z的第一电离能由大到小的顺序为
?(用元素符号表示)。
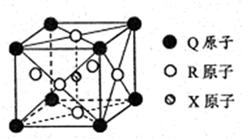
(3)一种新型导体晶体的晶胞如右图所示,则该晶体的化学式为?,其中一个Q原子紧邻?个R原子。
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是?弱酸HXY分子中存在的σ键与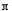 键的数目之比为?。
键的数目之比为?。
参考答案:(16分,每空2分)(1)sp2?三角锥形?(2)1s22s22p63s23p63d84s2或[Ar]3d84s2? N>O>C
(3)MgNi3C? 12?(4)Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-? 1:1
本题解析:X基态原子的核外电子分布在3 个能级,且各能级电子数相等,这说明X的原子序数是2+2+2=6,因此X是碳元素。Z是地壳中含量最多的元素,则Z是氧元素;Y的原子序数介于X与Z之间,所以Y是氮元素。W是电负性最大的元素,所以W是氟元素。元素Q的核电荷数等于Y、W原子的最外层电子数之和,因此Q的原子序数=5+7=12,则Q是镁元素。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,所以R是镍元素。
(1)微粒XZ32-是CO32-,中心原子碳原子含有的孤对电子对数=(4+2-3×2)÷2=0,所以该微粒的空间构型是平面正三角形,则碳原子杂化类型为 sp2杂化;化合物YW3是NF3,根据价层电子对互斥理论可知,中心原子N原子含有的孤对电子对数=(5-3×1)÷2=1,因此NF3分子空间构型为三角锥形结构。
(2)根据构造原理可知,镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以元素X、Y、Z的第一电离能由大到小的顺序为N>O>C。
(3)根据晶胞结构并依据均摊法可知,晶胞Mg原子的个数=8×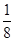 =1个;Ni原子的个数=6×
=1个;Ni原子的个数=6×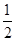 =3个;碳原子的个数=1个,所以其化学式为MgNi3C。由于顶点被周围的8个正方体共用,所以根据晶胞结构可判断一个Mg原子紧邻(3×8)÷2=12个Ni原子。
=3个;碳原子的个数=1个,所以其化学式为MgNi3C。由于顶点被周围的8个正方体共用,所以根据晶胞结构可判断一个Mg原子紧邻(3×8)÷2=12个Ni原子。
4)R的氢氧化物Ni(OH)2能溶于含CN-离子的溶液生成一种配离子[Ni(CN)4]2-,其中CN-是配体,因此反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-。HCN分子中含有1个碳氢单键和1个碳氮三键,由于单键是σ键,三键是由1个σ键与2个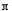 键构成的,所以化合物HCN分子中存在的σ键与
键构成的,所以化合物HCN分子中存在的σ键与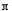 键的数目之比为2:2=1:1。
键的数目之比为2:2=1:1。
本题难度:一般
2、填空题 用电子式表示。
(1)氧原子___________________
(2)氮气___________________
(3)氯化镁的形成过程_____________________
参考答案:(1)?“略”
(2)“略”
(3)
本题解析:
本题难度:一般
3、简答题 【选修3物质结构与性质】(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是?;
 ?
?
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为?;
(3)Se原子序数为?,其核外M层电子的排布式为??;
(4)H2Se的酸性比H2S?(填“强”或“弱”)。气态SeO3分子的立体构型
为?,SO32-离子的立体构型为?;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:?
?;
② H2SeO4比 H2SeO3酸性强的原因:?
?
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为?(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为?pm(列示表示)
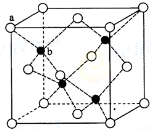
参考答案:(1)SP3
(2)O>S>Se
(3)34? 3s23p63d10
(4)强?正四面体?平面三角形
(5)①H2SeO4和H2SeO3第一步电离产生的氢离子抑制第二步电离,所以第一步电离程度大于第二步电离程度。
②对同一种元素的含盐酸来说,该元素的化合价越高,其含氧酸的酸性越强。
(6)4.1?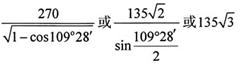
本题解析:(1)因为S8为环状立体结构,键角为120°,所以轨道杂化方式为SP3。
(2)根据同主族电离能变化规律,O、S、Se原子的第一电离能由大到小的顺序为O>S>Se.(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10(4)原子半径越大,氢化物越容易电离出氢离子,所以H2Se的酸性比H2S强。气态SeO3分子的立体构型为正四面体,SO32-离子的立体构型为平面三角形。(5)①H2SeO4和H2SeO3第一步电离产生的氢离子抑制第二步电离,所以第一步电离程度大于第二步电离程度。

【考点定位】原子的结构与性质、分子的结构与性质、晶体结构与性质、晶体的计算
本题难度:一般
4、选择题 上个世纪80年代,科学家通过研制发现了一种新分子,这种新分子具有空心的类似足球状的结构,其化学式是C60。有关C60的下列说法中不正确的是
A.C60中不可能含有离子键
B.C60中的化学键只有共价键
C.C60是一种新型的化合物
D.C60和金刚石都是由碳元素组成的单质
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列分子的结构中,原子的最外层都能满足8电子稳定结构的是
[? ]
A.BF3?
B.CCl4?
C.CH4?
D.PCl5
参考答案:B
本题解析:
本题难度:简单