微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素
| 性质或结构信息
|
A
| 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。
|
B
| 原子的M层有1个未成对的p电子。核外p电子总数大于7。
|
C
| 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。
|
D
| 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。
|
E
| 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。
|
F
| 周期表中电负性最大的元素
|
?
(1)A原子的最外层电子排布式?,D原子共有?种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系:?>?(填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是?;分子较稳定的是?。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
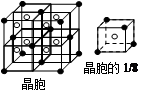
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是?。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。
参考答案:(1)3s23p4(2分),14(1分)。(2)N,F (各1分,共2分)
20090116
?(3)H2S(2分),HCl(2分)?(4)Al-3e-+4OH- =AlO2-+2H2O(2分)(5)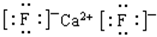 (2分)?
(2分)?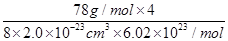 =3.2 g/cm3(列式2分,结果1分,无单位扣1分)
=3.2 g/cm3(列式2分,结果1分,无单位扣1分)
本题解析:A、单质常温下为固体,难溶于水易于溶CS2,能形成2种二元含氧酸,因此A是S;B、原子的M层有1个未成对的p电子,核外p电子总数大于7,则B应该是Cl;C、单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,单质能溶强酸和强碱,所以C是Al;D、原子核外电子层上s电子总数比p电子总数少2个,单质和氧化物均为空间网状晶体,具有很高的熔、沸点,则D是Si;E、其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高,则E是N;F、周期表中电负性最大的元素是F,即F是氟元素。
(1)S元素位于第三周期第ⅥA族,所以S原子的最外层电子排布式为3s23p4;Si元素的原子序数是14,核外电子数是14个,所以Si原子共有14种不同运动状态的电子。
(2)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,其第一电离能大于氟元素的,所以F与E元素第一电离能的大小关系:N>F。
(3)非金属性是S弱于Cl,所以两种元素的氢化物分子中键能较小的是H2S;非金属性越强,氢化物的稳定性越强,因此分子较稳定的是HCl。
(4)原电池中较活泼的金属做负极,镁的金属性强于Al。但由于铝能和氢氧化钠溶液,二镁不能,所以单质铝、镁、NaOH溶液构成的原电池中铝是负极,镁是正极,因此负极的电极反应式为Al-3e-+4OH- =AlO2-+2H2O。
(5)根据晶胞的结构图并依据均摊原理可知,氟原子的个数=8个,钙原子的个数=8×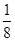 +6×
+6×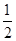 =4个,因此该化合物的化学式为CaF2,含有离子键的离子化合物,因此其电子式为
=4个,因此该化合物的化学式为CaF2,含有离子键的离子化合物,因此其电子式为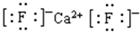 ;已知该化合物晶胞1/8的体积为2.0×10-23cm3,则该晶胞的体积是8×2.0×10-23cm3,因此根据晶胞中钙离子的个数是4个可知
;已知该化合物晶胞1/8的体积为2.0×10-23cm3,则该晶胞的体积是8×2.0×10-23cm3,因此根据晶胞中钙离子的个数是4个可知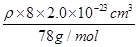 ×6.02×1023/mol=4,解得ρ=
×6.02×1023/mol=4,解得ρ=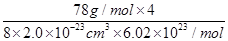 =3.2 g/cm3。
=3.2 g/cm3。
本题难度:一般
2、选择题 氨分子中不存在
[? ]
A.共价键
B.离子键
C.极性键
D.共用电子对
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列分子含有的电子数目与HF相同,且只有两个极性共价键的是
[? ]
A.CO2
B.N2O
C.H2O
D.CH4
参考答案:C
本题解析:
本题难度:简单
4、选择题 已知六氟化硫分子呈正八面体,具有很好的绝缘性,即使在高电压下熔融也不导电,在电器行业有着广泛用途,但其沸点较低,逸散到空气中会引起温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成SO2
B.SF6形成的晶体是原子晶体
C.SF6晶体融化时不需破坏化学键
D.SF6中各原子均达到8电子稳定结构
参考答案:C
本题解析:SF6中S元素为+6价,F为-1价,所以不能燃烧生成二氧化硫,A错;SF6形成的晶体是分子晶体,B错;SF6中存在6个S—F键,F为达到八电子稳定结构,S超过八电子,C错;由题意可知SF6晶体融化时不需破坏化学键是正确的,C正确。故本题选C。
本题难度:一般
5、填空题 选择下列物质填空(填写序号):
①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠 ⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体
(1)固态时能导电的有_____________
(2)熔化时不破坏化学键的有_____________
(3)含有配位键的有_____________
(4)含有非极性共价键的有_____________
参考答案:(1)⑧⑩
(2)②③④
(3)⑨
(4)①④⑥⑧
本题解析:
本题难度:一般