微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃、101kPa下,碳、氢气和甲烷的燃烧热依次是393.5 kJ·mol—1、285.8 kJ·mol—1
和890.3kJ·mol—1,下列选项中正确的是
A.2H2(g)+O2(g)=2H2O(l)△H=—285.8kJ·mol—1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ·mol—1
C.H2(g)+1/2O2(g)=H2O(g)△H<—285.8kJ·mol—1
D.C(s)+2H2(g)=CH4(g)△H=—74.8 kJ·mol—1
参考答案:D
本题解析:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:①C(S)+O2(g)═CO2(g)△H=-393.5kJ·mol-1;②H2(g)+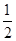 O2(g)═H2O(l)△H=-285.8kJ·mol-1;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ·mol-1,根据盖斯定律解答,2H2(g)+O2(g)=2H2O(l)?△H=—571.6kJ·mol—1,A选项错误;甲烷燃烧是放热,应该是△H=-890.3kJ·mol—1,B选项错误;液态水变为气态水,要吸收一部分热量,所以△H>—285.8kJ·mol—1;C选项错误;根据盖斯定律③-(①+②×2)得CH4(g)=C(S)+2H2(g),故△H=(-890.3KJ·mol-1)-[(-393.5KJ·mol-1)+(-285.8kJ·mol-1)×2]=+74.8KJ·mol-1,D选项正确。
O2(g)═H2O(l)△H=-285.8kJ·mol-1;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ·mol-1,根据盖斯定律解答,2H2(g)+O2(g)=2H2O(l)?△H=—571.6kJ·mol—1,A选项错误;甲烷燃烧是放热,应该是△H=-890.3kJ·mol—1,B选项错误;液态水变为气态水,要吸收一部分热量,所以△H>—285.8kJ·mol—1;C选项错误;根据盖斯定律③-(①+②×2)得CH4(g)=C(S)+2H2(g),故△H=(-890.3KJ·mol-1)-[(-393.5KJ·mol-1)+(-285.8kJ·mol-1)×2]=+74.8KJ·mol-1,D选项正确。
本题难度:一般
2、选择题 下列说法正确的是
A.溶液的pH值越小,溶液中含有的氢离子数就越多
B.物质的水溶液浓度越高,则溶液的密度越大
C.单质的化学活动性越强,氧化性也越强
D.相同条件时,酸性越弱的酸,其对应的钠盐的水溶液碱性越强
参考答案:A
本题解析:溶液的pH值越小,溶液中氢离子的浓度就越大,但氢离子数不一定越大,选项A不正确;B不正确,例如氨水但浓度越大,溶液的密度是越小的;C不正确,单质的化学活动性越强,亚可能是还原性越强;酸越弱,相应的钠盐就越容易水解,溶液的碱性就越强,选项D正确,答案选D。
本题难度:一般
3、选择题 在下列各组离子在指定溶液中,一定能大量共存的是
A.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、I-
B.水电离的H+浓度为1×10-13mol·L-1的溶液中,K+、Al3+、Cl-、SO42-
C.AlO2?浓度为0.1 mol·L-1的溶液中: Na+、K+、HCO3-、Cl-
D.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3-
参考答案:D
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中溶液显酸性,Fe3+、NO3-均能氧化I-,不能大量共存;B中水的电离平衡被抑制,因此溶液可能显酸性,也可能显碱性。如果显碱性,则Al3+不能大量共存。C中AlO2-和HCO3-反应生成氢氧化铝和CO32-,不能大量共存。D中溶液含有铁离子,可以大量共存,答案选D。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
4、选择题 已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-890kJ/mol
B. CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l);△H=-445kJ/mol
CO2(g)+H2O(l);△H=-445kJ/mol
C.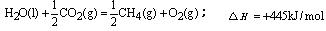
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol
参考答案:D
本题解析:题目中给出的数据意义是:燃烧1g的甲烷放出55.625kJ的热量,应该换算成燃烧1mol甲烷放出的热量为890kJ。热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ·mol-1其他系数与热量相对应的方程式均正确。
本题难度:简单
5、填空题 直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:?。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是?
(3)吸收液吸收SO2的过程中,pH随n(SO3?﹣):n(HSO3﹣)变化关系如下表:
n(SO3?﹣):n(HSO3﹣)
| 91:9
| 1:1
| 1:91
|
pH
| 8.2
| 7.2
| 6.2
|
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
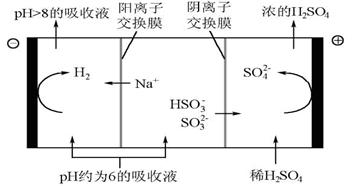
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
参考答案:(1)SO2+H2O H2SO3,2 H2SO3+O2
H2SO3,2 H2SO3+O2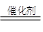 2H2SO4;(2)SO2+2OH- =SO32-+H2O;(3)酸; HSO3-存在:HSO3-
2H2SO4;(2)SO2+2OH- =SO32-+H2O;(3)酸; HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度;ab;(4)HSO3-+H2O-2e- =3H++SO42-;H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度;ab;(4)HSO3-+H2O-2e- =3H++SO42-;H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
本题解析:(1)SO2形成硫酸型酸雨时,二氧化硫和空气中的水、氧气反应得到硫酸:SO2+H2O H2SO3,2 H2SO3+O2
H2SO3,2 H2SO3+O2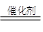 2H2SO4;(2)二氧化硫被氢氧化钠溶液吸收制备亚硫酸钠溶液时:SO2+2OH- =SO32-+H2O;(3)根据表中数据,可知,n(SO3?﹣):n(HSO3﹣)=1:91时,溶液的pH值为酸性,故NaHSO3溶液显酸性,在亚硫酸氢钠溶液中HSO3-存在:HSO3-
2H2SO4;(2)二氧化硫被氢氧化钠溶液吸收制备亚硫酸钠溶液时:SO2+2OH- =SO32-+H2O;(3)根据表中数据,可知,n(SO3?﹣):n(HSO3﹣)=1:91时,溶液的pH值为酸性,故NaHSO3溶液显酸性,在亚硫酸氢钠溶液中HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性。当吸收液呈中性时,溶液中的c(H+)=c(OH-),由于溶液中存在着电荷守恒,故c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),可推出:c(Na+)=2c(SO32-)+c(HSO3-),a对;由于n(SO?﹣):n(HSO?﹣)=1:1时,溶液的pH值为7.2,故中性时一定有c(HSO3-)> c(SO32-),可推出:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-),b对;(4)根据电解槽所示的变化,可知HSO3-在阳极放电的电极反应式是:HSO3-+H2O-2e- =3H++SO42-;H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性。当吸收液呈中性时,溶液中的c(H+)=c(OH-),由于溶液中存在着电荷守恒,故c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),可推出:c(Na+)=2c(SO32-)+c(HSO3-),a对;由于n(SO?﹣):n(HSO?﹣)=1:1时,溶液的pH值为7.2,故中性时一定有c(HSO3-)> c(SO32-),可推出:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-),b对;(4)根据电解槽所示的变化,可知HSO3-在阳极放电的电极反应式是:HSO3-+H2O-2e- =3H++SO42-;H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
【考点定位】此题以二氧化硫形成酸雨为背景,综合考查了化学反应方程式书写、离子方程式书写、水溶液中的离子平衡、溶液中的离子浓度大小比较、电解原理等知识。
本题难度:一般