微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于有气体参加的反应,下列措施均能加快反应速率,其中不是因为增大反应体系活化分子百分数而加快反应速率的是( )
A.缩小体积以增加反应体系的压强
B.保持体积不变,增大反应物的浓度
C.升高反应体系的温度
D.加入催化剂
参考答案:浓度与压强可增大反应体系中单位体积活化分子的数目,则反应速率加快;温度与催化剂可增大反应体系中活化分子的百分数.
A、改变气体的压强,可增大反应体系中单位体积活化分子的数目,故A正确;
B、改变气体物质的浓度,增大了反应体系中单位体积活化分子的数目,故B正确;?
C、改变气体的温度,提供能能量,有效碰撞的机会增大,增大了反应体系中活化分子的百分数,故C错误;?
D、加入催化剂,降低了反应所需的活化能,增大了反应体系中活化分子的百分数,故D错误.
故选AB.
本题解析:
本题难度:简单
2、填空题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题。
(1)实验1?探究Mg与盐酸反应速率的变化规律

取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中。镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示。
① 从图2中看出0-6min内平均反应速率最快的时间段是?。(填代号)
A.0-2min?B.2-4min? C.4-6min
② 请计算4-6min 时间内,用HCl表示的平均反应速率为________。(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变?B.减慢反应但增大生成氢气总量?
C.不影响反应速率? D.加快反应速率但生成氢气的总量减小
(2)实验2?探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+?Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0 mL氧气所需时间。
实验编号
| Ⅰ
| Ⅱ
| Ⅲ
| Ⅳ
|
10%H2O2的体积/mL
| 5.0
| 5.0
| V1
| V2
|
20%硫酸的体积/mL
| 0
| 0.5
| 1.0
| V3
|
水的体积/m L
| 15
| 14.5
| V4
| 13.5
|
所需时间t/s
| t1
| t2
| t3
| t4
|
①上表中V1=?mL, V3=?mL。
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是?。
③若实验测得t2>t3>t4,则可得出的实验结论是?。
参考答案:(10分)(1)① B(1分)② 0.1mol/(L·min)(2分,单位没写或写错扣1分)③A(1分)
(2)① 5.0(1分)? 1.5?(1分)? ②实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同。(只回答没加硫酸无可比性不得分)(2分)
③酸浓度越大,反应速率越快(2分)
本题解析:(1)①反应速率越快,相应曲线的斜率越大,则根据图像可知,反应速率最快的是2-4min内,即答案选B。
②根据图像可知,4-6min内生成氢气的体积是34.48ml-30.00ml=4.48ml,物质的量是0.002mol,所以消耗盐酸的物质的量是0.004mol,则用盐酸表示的反应速率是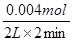 =0.1mol/(L·min)。
=0.1mol/(L·min)。
③与镁条相连的铜丝若一起浸入稀盐酸中,则构成原电池,加快反应速率,但生成氢气的总量不变,所以答案选A。
(2)①要探究酸浓度对MnO2与H2O2反应速率的影响,则双氧水的浓度应该是相等的,所以V1=5ml。又因为最终溶液的体积必须相等,所以V3=20.0ml-13.5ml-5.0ml=1.5ml。
②实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同,所以实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验。
③若实验测得t2>t3>t4,而实验Ⅱ、Ⅲ、Ⅳ中酸的浓度逐渐增大,这说明酸浓度越大,反应速率越快。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和解题方法的指导,有利于培养学生的逻辑思维能力和抽象思维能力,提高学生分析问题、解决问题的能力。
本题难度:困难
3、选择题 下列说法违反科学原理的是( )
A.为了消除腆缺乏症,可以采用在食盐中加人少量碘酸钾的方法
B.闪电时,空气中的N2发生的变化可称为氮的固定
C.干冰可用于人工降雨
D.在二氧化硫转化成三氧化硫的反应中,使用催化剂可提高S02的转化率
参考答案:A、碘酸钾可以为人体补充碘元素,为了消除腆缺乏症,可以采用在食盐中加人少量腆酸钾的方法,符合科学原理,故A错误;
B、闪电时,空气中的N2和氧气发生反应生成一氧化氮,该过程称为氮的固定,符合科学原理,故B错误;
C、干冰是二氧化碳的固态存在形式,放在空气中能迅速吸收大量的热使周围的温度快速降低,使水蒸气液化成小水滴,从而降雨的目的,符合科学原理,故C错误;
D、在二氧化硫转化成三氧化硫的反应中,使用催化剂可提高化学反应速率,不能提高S02的转化率,不符合科学原理,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 在锌和稀硫酸制氢气的反应中,要使反应速率加快应采取的措施是( )
A.加入少量硫酸铜溶液
B.加入少量氯化锌溶液
C.把纯锌换成有杂质的锌
D.把稀硫酸换成浓硫酸
参考答案:A.加入少量硫酸铜溶液,置换出铜,构成原电池使反应速率加快,故A正确;
B.加入少量氯化锌溶液,溶液浓度减小,反应速率减小,故B错误;
C.把纯锌换成有杂质的锌,构成原电池使反应速率加快,故C正确;
D.锌和浓硫酸反应不放氢气,而是生成二氧化氯气体,故D错误.
故选AC.
本题解析:
本题难度:一般
5、选择题 反应C(S)+H2O(g)  ?CO(g)+H2(g),在一体积可变的密闭容器中进行下列条件的改变对其化学反应速率几乎没有影响的是 (?)
?CO(g)+H2(g),在一体积可变的密闭容器中进行下列条件的改变对其化学反应速率几乎没有影响的是 (?)
①增加C的用量;?
②将容器的体积缩小一半;
③保持体积不变,充入氮气使容器内压强增大;
④保持压强不变,充入氮气使容器的体积增大
A.①③
B.②④
C.③④
D.①④
参考答案:A
本题解析:略
本题难度:简单