微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。
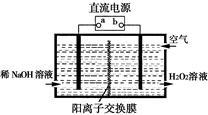
试回答:
①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
参考答案:(1)①正极② O2 + 2e-+ 2H2O=H2O2 + 2OH-③能耗低
(2)①深 ②H2O2分解放热,使平衡2NO2 N2O4向生成NO2方向移动
N2O4向生成NO2方向移动
(3)Cu + H2O2 +2H+=Cu2+ + 2H2O;温度升高,H2O2分解速率加快 (每空2分)
本题解析:(1)①根据装置图可知,与电源b极相连的电极产生双氧水,由于利用空气中氧气在阴极还原得到H2O2和稀碱的混合物,这说明该电极是阴极,即b是负极,则a是正极。
②电解池中阴极得到电子,发生还原反应,双氧水在阴极产生,则阴极电极反应式为O2 + 2e-+ 2H2O=H2O2 + 2OH-。
③由于电解法需要消耗大量的电能,所以该方法的另外一个优点是能耗低。
(2)由于Fe3+对H2O2的分解具有催化作用,根据图像可知而双氧水分解是放热反应,所以B瓶中溶液温度高。又因为NO2转化为N2O3是放热反应,升高温度促使平衡2NO2 N2O4向生成NO2方向移动,所以颜色深。
N2O4向生成NO2方向移动,所以颜色深。
(3)双氧水具有氧化性,在稀硫酸溶液中能把铜氧化生成硫酸铜和水,反应的离子方程式为Cu + H2O2 +2H+=Cu2+ + 2H2O。由于双氧水不稳定,受热易分解,温度过高时导致H2O2分解速率加快,因此铜的平均溶解速率随着反应温度的升高反而下降。
考点:考查电化学原理的应用、双氧水性质以及外界条件对反应速率和平衡状态的影响
本题难度:困难
2、选择题 已知可逆反应:N2(g)+3H2(g)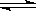 2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是(?)?
2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是(?)?
A.加压可使该反应的反应速率变大
B.升高温度,该反应的正、逆反应速率均变大
C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ
D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
参考答案:C
本题解析:考查外界条件对反应速率和平衡对影响以及反应热的计算。反应有气体参加和生成,所以加压可以加快反应速率,A正确。升高温度一定加快反应速率,B正确。反应是可逆的,因此1mol氮气和3mol氢气不可能生成2mol氨气,所以放出的能量一定小于92kJ,C不正确。选项D中的反应速率方向是相反,且满足速率之比是相应的化学计量数之比,所以可以说明正逆反应速率相等,D正确。答案是C。
本题难度:一般
3、选择题 (2左11?合肥三模)某密闭容器中充入等物质的最的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示.下列说法中正确是( )
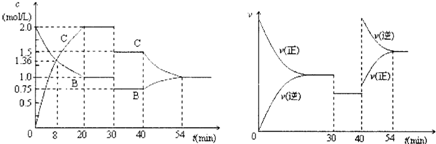
A.8min时表示正反应速率等于逆反应速率
B.前20minA的反应速率为0.05mol/(L?min)
C.反应方程式中的x=1,30min时表示增大压强
D.40min时改变的条件是升高温度,且正反应为吸热反应
参考答案:A、根据图象可知:8min时B、C的浓度相等,此时仍向正反应方向进行,即正反应速率5于逆反应速率,故A错误;
B、前20minA的反应速率为v(A)=如2v(C)=2mol?L-如20min×2=0.05mol/(L?min&nb六p;),故B正确;
C、在反应中B、C的物质的量浓度变化之比为如:2,根据化学方程式可知x=如,故该反应为气体体积不变的反应,即反应过程中气体的压强不变,增5压强,B、C的物质的量浓度都将增5,故C错误;
D、升高温度,平衡向吸热反应方向进行,即逆反应为吸热反应,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是?
[? ]
A.加热?
B.加入硝酸钠固体
C.滴加少量CuSO4溶液?
D.不用铁片,改用铁屑
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列条件:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④不断分离出生成物 ⑤加入MnO2,
一定能使反应速率增大的是( )
A.②
B.②③
C.①②⑤
D.全部
参考答案:①增加反应物的物质的量,化学反应速率不一定增大,比如增加固体物质的量,不会引起反应速率的变化,故①错误;
②升高温度,会使得所有化学反应速率均加快,故②正确;
③缩小反应容器的体积,即增大压强,仅仅适用于体参加的反应,故③错误;
④不断分离出生成物(不是固体产物),会导致化学反应速率减慢,故④错误;
⑤加入MnO2,仅会使得部分化学反应速率加快,催化剂具有专一性的特点,故⑤错误.
故选A.
本题解析:
本题难度:简单