微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分离提纯方法不正确的是
A.分离KNO3的氯化钠,常用结晶与重结晶
B.提纯含有碘单质的食盐,常用升华法
C.除去乙酸乙酯中的乙酸,可加入NaOH溶液后分液
D.分离苯和酸性高锰酸钾溶液可用分液法
参考答案:C
本题解析:
本题难度:困难
2、填空题 (9分)下图为周期表中的一部分。已知A、B、C、D均为短周期元素,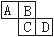
A与D原子序数之和为C原子序数的1.5倍。
(1)B元素符号是: _______、D在元素周期表中第_______族。
(2)四种元素中原子半径最大的是(填元素符号)_______,B、C、D三种离子中半径最大的是(填离子符号)_______。
(3)B比C的氢化物的沸点高是因为_____?__;A、D两元素的气态氢化物相互反应的生成物的电子式:?,其中存在_______键、_______(填“极性”或“非极性”)共价键。
(4)写一个离子方程式证明C和D的非金属性相对强弱:?。
参考答案:(1)O;ⅦA族;(2)S;S2-;(3)水分子间有氢键;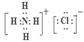 离子、极性;
离子、极性;
(4)S2-+Cl2=S↓+2Cl-
本题解析:假设B的原子序数是a,则A是a-1,C是a+8,D是a+9.根据题意可得(a-1)+(a+9)= 1.5(a+8)。解得a=8,所以这几种元素分别是:A是N;B是O;C是S;D是Cl。(1)B元素符号是O;D在元素周期表中第ⅦA族;(2)同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。所以这四种元素中原子半径最大的是S。电子层结构相同的微粒,核电荷数越大,离子半径就越小;电子层结构不同的微粒,离子核外电子层数越多,离子半径就越大,所以B、C、D三种离子中半径最大的是S2-;(3)O和S是同族元素,它们的氢化物的结构相似,而沸点H2O的比H2S高是因为水分子间有氢键,增加了分子之间的相互吸引,使物质汽化消耗的能量高;A、D两元素的气态氢化物相互反应的生成物NH4Cl的电子式是 。其中存在离子键、极性共价键;(4)活动性强的元素的单质能够把活动性弱的元素从化合物中置换出来,证明C和D的非金属性相对强弱的一个离子方程式是:S2-+Cl2=S↓+2Cl-。
。其中存在离子键、极性共价键;(4)活动性强的元素的单质能够把活动性弱的元素从化合物中置换出来,证明C和D的非金属性相对强弱的一个离子方程式是:S2-+Cl2=S↓+2Cl-。
本题难度:一般
3、填空题 4g D2和20g 18O的单质化合时最多能生成?g D2O, 1mol D2O中含_______mol质子,含 mol中子。
参考答案:22? 10? 10
本题解析:4g D2和20g 18O2的物质的量分别是1mol和5/9mol,所以18O2过量,因此生成1molD218O,质量是22g。D2O中含有10个质子,10个中子,所以1mol D2O中含10mol质子,含10mol中子。
本题难度:简单
4、填空题
请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有?,用离子方程式表示X溶液呈酸性的原因是?。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:?。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体已知[n(A):n(B)=3:1],可放出l8.44 kJ热量,则该反应的热化学方程式为?。
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为?。
(5)在10L的密闭容器中,通人2molFC2气体和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为??。
参考答案:
(1)离子键、共价键,NH4++H2O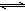 NH3·H2O+H+
NH3·H2O+H+
(2)Si+2OH-+H2O=SiO32-+2H2↑。
(3)N2(g)+3H2(g) 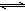 2NH3(g)?ΔH=-92.2 kJ·mol-1。
2NH3(g)?ΔH=-92.2 kJ·mol-1。
(4)H2-2e-+2OH-=2H2O。
(5)0.90 (90%)
本题解析:六种元素处于不同周期,原子序数依次增大,其中B、C同一周期,D、F同一周期,可以判断A为第一周期,B、C为第二周期,D、F为第三周期,A、D为同一主族,故A为H,D为Na,C、F为同一主族,且C原子的最外层电子数是次外层电子数的三倍,最外层电子数不能超过8个,故C的电子排布为K层2,L层6,故C为O,F为S;因此6种物质中有3中气体单质,其中已经判断出的氢、氧单质为气体,所以B、E必有一种为气体,D(Na)和F(S)之间无气体单质,故气体单质只能是处于A、C之间的B,该区间只有N形成气体,即B为N元素;E为位于D(钠)到F(S)之间的元素。
(1)A、B、C分别为H、N、O三元素;不难判断X为NH4NO3,其化学键类型为离子键、共价键;NH4NO3为强酸弱碱盐,水解显酸性。NH4++H2O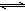 NH3·H2O+H+。
NH3·H2O+H+。
(2)由题目信息可以判断,E为Si,与碱反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。
(3)由题目给出的信息,可以判断,该过程为H2与N2合成铵的反应,生成1 mol NH3放出的热量为:18.44kJ/(6.8g/17g·mol-1)=46.1 kJ·mol-1,故热化学方程式为:N2(g)+3H2(g) 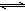 2NH3(g)?ΔH=-92.2 kJ·mol-1。
2NH3(g)?ΔH=-92.2 kJ·mol-1。
(4)M极通入氢气,该极为电池的负极,其电极反应为:H2-2e-+2OH-=2H2O。
(5)SO2与O2生成SO3,反应式为2SO2+O2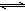 2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
本题难度:简单
5、选择题 几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是
元素代号
| A
| B
| D
| E
| G
| H
| I
| J
|
化合价
| –1
| –2
| +4、–4
| –1
| +5、–3
| +3
| +2
| +1
|
原子半径/nm
| 0.071
| 0.074
| 0.077
| 0.099
| 0.110
| 0.143
| 0.160
| 0.186
|
? A.A的单质能将E单质从HE3的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
参考答案:B
本题解析:略
本题难度:一般