微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 只用下列一种试剂,就能将Ba(NO3)2、NaAlO2、NaHCO3、AlCl3四种无色透明溶液区别开来,这种试剂是? (? )
A.硫酸
B.盐酸
C.氨水
D.氢氧化钠溶液
参考答案:A
本题解析:硫酸与Ba(NO3)2反应生成白色沉淀BaSO4,与NaAlO2反应先生成白色沉淀,沉淀在溶解。与NaHCO3反应有气泡生成,与AlCl3不反应,没有现象。
本题难度:一般
2、选择题 下列除杂的方案中正确的是(括号内为除去杂质所需的药品)( )
A.NaOH溶液中混有Ba(OH)2(CuSO4溶液)
B.CO2气体中混有CO(炽热的炭)
C.Cu(NO3)2溶液中混有AgNO3(Cu粉)
D.CO2气体中混有HCl气体(NaOH溶液)
参考答案:A、Ba(OH)2和CuSO4溶液反应生成硫酸钡和氢氧化铜沉淀,但是氢氧化钠也可以和硫酸铜反应生成氢氧化铜沉淀,不但除去了杂质,自身也和所加试剂反应了,不符合除杂原则,故A错误;
B、二氧化碳可以和炽热的碳单质反应,但是一氧化碳和碳不反应,这样杂质没有除掉,要保留的物质反而消耗,不符合除杂原则,故B错误;
C、Cu粉可以和Cu(NO3)2溶液中混有AgNO3反应生成硝酸铜和金属单质银,再过滤可以获得Cu(NO3)2溶液,故C正确;
D、氢氧化钠可以和二氧化碳以及氯化氢反应,不但除了杂质,要保留的物质反而也消耗,不符合除杂原则,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 与3.2 g SO2所含的氧原子数相等的NO2的质量为 ? ?
A.3.2 g
B.4.6 g
C.6.4 g
D.2.3 g
参考答案:D
本题解析:试题分析:3.2gSO2的物质的量是3.2g÷64g/mol=0.05mol,则含有生物氧原子是0.05mol×2=0.1mol,则NO2的物质的量是0.1mol÷2=0.05mol,其质量是0.05mol×46g/mol=2.3g,答案选D。
考点:考查物质的量的有关计算
点评:该题是高考中的常见考点,难度不大,试题注重基础和能力的双向考查,有利于培养学生分析问题、解决问题的能力。该题的关键是弄清楚分子和组成分子的原子的关系,然后灵活运用即可。
本题难度:简单
4、实验题 Ⅰ:选择一种试剂鉴别下列各组物质,将所选试剂的化学式或名称写在横线上:
① 苯、甲苯??② 苯、硝基苯、乙醇?
③ 苯酚溶液、己烯、己烷、醋酸溶液?
Ⅱ:为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计如下甲、乙两方案。
方案甲:
实验1:取少量无水乙醚于试管中,加入少量金属钠。
实验2:各取3mL无水乙醚于试管中,分别加入少量等物质的量的苯酚和乙醇,再投入大小相同的钠块。
方案乙:
各取少量等物质的苯酚和乙醇于试管中,均在60℃的水浴加热,待苯酚熔化后,各放入相同大小的一小块金属钠。(已知:苯酚的密度为1.07g/mL)
(1)方案甲设计实验1的目的是?。
(2)方案乙中观察到:在乙醇中,钠很快与乙醇反应产生气体,溶液保持澄清;在苯酚中,钠块表面有少量气泡,且表面产生白色悬浮物,最后白色悬浮物充满苯酚熔融液。
①实验中观察到的白色悬浮物为?;
②苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其可能原因有____________、_____________。
参考答案:I:①酸性KMnO4溶液、②水、③溴水 (其它合理答案也给分)(每空1分)
II: ①证明 钠与乙醚不反应,烃基上的氢不能被钠取代 。(2分)?②?苯酚钠
(2分)③反应物接触面积小,生成的苯酚钠将钠包起来,阻止了反应的进行。(2分)
本题解析:Ⅰ①苯、甲苯可以用酸性KMnO4溶液来鉴别,因为甲苯能够被酸性KMnO4溶液从而使其褪色,而苯不能;②苯、硝基苯、乙醇可以用水来鉴别,乙醇可以和水互溶,而苯、硝基苯与水不互溶,苯的密度比水小,在上层,而硝基苯的密度比水大,在下层;③苯酚溶液、己烯、己烷、醋酸溶液可以用溴水来鉴别,苯酚与溴水反应生成了白色沉淀,己稀能够使溴水褪色,己烷与溴水发生了萃取作用,上层为红色,醋酸与溴水互溶;
Ⅱ取少量无水乙醚于试管中,加入少量金属钠的目的是证明 钠与乙醚不反应,烃基上的氢不能被钠取代;①苯酚与钠反应得到苯酚钠和氢气,所以实验中观察到的白色悬浮物为苯酚钠;②苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其可能原因有反应物接触面积小,生成的苯酚钠将钠包起来,阻止了反应的进行。
点评:本题考查了物质的鉴别、探究性实验,这种题型是高考的常见题型,本题有利于提高学生的探究性思维,本题难度适中。
本题难度:简单
5、实验题 (6分)在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
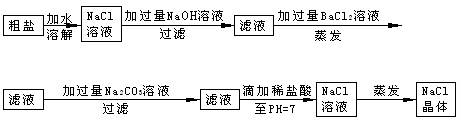
试简要说明(1)加入过量BaCl2的溶液的原因_______??。
(2)加入过量Na2CO3的溶液的原因______?___?_?_。
(3)滴加稀盐酸直至pH=7的目的是____?___?__。
参考答案:(1)使SO42-完全沉淀而除去?(2)使Ba2+完全沉淀而除去?(3)除去过量的OH-、CO32-,得到NaCl溶液
本题解析:略
本题难度:一般