微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去NaCl中混有的?MgCl2、Na2SO4时选用( )
A.NaOH、Ba(NO3)2、Na2CO3、HCl
B.Ca(OH)2、Mg(NO3)2、Na2CO3、HCl
C.NaOH、BaCl2、Na2CO3、HCl
D.Na2CO3、BaCl2、KOH、HCl
参考答案:因为反应要在溶液中进行,所以要先配制成溶液,然后除去硫酸根离子,再除钙离子和镁离子,最后加入盐酸除去过量的碳酸根和氢氧根.
实验步骤为:(1)将粗盐溶于足量水中制成溶液.
(2)向(3)虑液中加入足量的NaOH溶液,除去Mg2+,2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(3)向上述溶液中加入足量的BaCl2溶液,除去SO42-,Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)向上述虑液中加入足量的Na2CO3溶液,除去Ca2+、Ba2+,Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl;过滤,除去滤渣;
(5)向(4)虑液中滴加稀盐酸,调节PH=7,除去CO32-和OH-,Na2CO3+2HCl=H2O+CO2↑+2NaCl,NaOH+HCl=NaCl+H2O;
(6)将NaCl溶液蒸发,洗涤干燥,即得较纯净的食盐;
故除杂试剂为:NaOH、BaCl2、Na2CO3、HCl;
故选C.
本题解析:
本题难度:一般
2、实验题 已知化合物甲和乙都不溶于水和稀硫酸,甲可溶于98%的浓硫酸而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲(实验中使用的过滤器是过滤强酸性液体的耐酸过滤器)。请填写表中空格,完成由上述混合物得到固体甲的实验设计。

参考答案:①将固体混合物放入烧杯中加入98%的浓硫酸溶解
②过滤将烧杯中的物质倒入耐酸过滤器中过滤,取滤液
③将②的滤液用玻璃棒引流,沿烧杯壁慢慢倒入盛有一定量蒸馏水的大烧杯中,并不断搅拌,直至析出全部固体
④过滤将大烧杯中的物质倒入过滤器中过滤,得固体甲
⑤用蒸馏水淋洗滤纸上的固体甲2~3次,直到洗涤干净
⑥取新得到的洗涤液少许置于试管中,滴人酸化的BaCl2溶液,若没有白色浑浊出现,则说明沉淀已洗涤干净;若仍有白色浑浊出现,则说明沉淀还没洗干净
本题解析:
本题难度:一般
3、选择题 今有下列三个氧化还原反应:
(1)2FeCl3+2KI =2FeCl2+2KCl+I2
(2)2FeCl2+Cl2 = 2FeCl3
(3)2KMnO4+16HCl = 2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是
[? ]
A.FeCl3
B.KMnO4
C.Cl2
D.HCl
参考答案:A
本题解析:
本题难度:一般
4、填空题 (12分)除去括号内的杂质,写出所加试剂的化学式和相关反应的离子方程式。
(1)Cl-(SO42-)?,? ?;
?;
(2)SO42-(CO32-)?,?;
(3)NaCl(NaOH)?,?;

 (4)Fe2+(Cu2+)?,?;
(4)Fe2+(Cu2+)?,?;
参考答案:⑴BaCl2?Ba2++SO42- =BaSO4?⑵H2SO4?CO32-+2H+ =CO2 +H2O?
?⑶HCl? H+ +OH- = H2O?⑷Fe? Fe +Cu2+ ="Cu" +Fe2+
⑴除去SO42-,一般用Ba2+将其转化为沉淀,除杂过程中不能引入新的杂质,故除去Cl-中所含SO42-选用BaCl2合适。
⑵除去CO32-一般将其转化为气体,考虑溶液中主体阴离子为SO42-,故选用H2SO4.
⑶除去OH-一般考虑将其转化为水,或沉淀,结合主体物质NaCl,选用HCl较合适。
⑷除去Cu2+一般将其转化为沉淀或单质,考虑主体为Fe2+,用铁单质合适。
本题解析:略
本题难度:一般
5、选择题 下列实验操作中正确的是
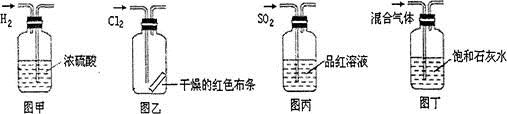
A.图甲所示,可得到干燥的氢气
B.图乙所示,可以验证氯气的漂白性
C.图丙所示,可以验证SO2的漂白性
D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2
参考答案:D
本题解析:A中不能得到干燥的氢气,因为进入管短,会把浓硫酸从长导管中压出,A错;布条是干燥的,无漂白性,B错;二氧化硫能使品红溶液褪色,证明二氧化硫的漂白性,C正确;能使澄清石灰水变浑浊不光是二氧化碳,也可能是二氧化硫,D错。答案选C。
本题难度:一般