微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列物质中的少量杂质(括号内为杂质),所选试剂和分离方法能达到目的是( )
A.苯(苯酚):溴水、过滤
B.CO2气体(HCl):饱和Na2CO3溶液、洗气
C.淀粉(氯化钠):蒸馏水、渗析
D.乙酸乙酯(乙酸):NaOH溶液、分液
参考答案:A 溴易溶于苯,则不能用溴水来除去苯中的苯酚,应选择NaOH溶液反应后分液,故A错误;
B.二氧化碳、HCl均能与Na2CO3溶液反应,应选饱和碳酸氢钠溶液来除去二氧化碳中的HCl,故B错误;
C.淀粉为胶体,不能透过半透膜,而NaCl溶液能,则可利用渗析法除去淀粉中的NaCl,故C正确;
D.乙酸乙酯在NaOH溶于中能水解,应选饱和碳酸钠溶液来除去乙酸乙酯中的乙酸,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 下列说法正确的是
A.1mol冰醋酸中含有6.02×1023个CH3COO-
B.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
C.同温同压下,两种气体物质的量之比等于密度比
D.同温同压下,两种气体的摩尔质量之比等于密度比
参考答案:D
本题解 析:
本题难度:简单
3、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

(1)写出步骤“还原”中可能发生反应的离子方程式?、?。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是?、?。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为?;向滤液M中加入(或通入)下列?(填字母)物质,得到另一种可循环利用的物质。
a.铁? b.氯气? c.高锰酸钾? d.盐酸
(4)保温除铁过程中加入CuO的目的是?、?;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是?;
操作X是?、?(填操作名称) 。
参考答案:(1)Fe +2Fe3+→3Fe2+?Fe +Cu2+→Cu+Fe2+
(2)温度高苯容易挥发,温度低溶解速率小
(3)HNO3 (1分) ?b (2分)
(4)调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀
(5)抑制Cu2+的水解(1分)?蒸发浓缩、冷却结晶(2分)
本题解析:(1)辉铜矿与氯化铁溶液反应生成氯化铜、氯化亚铁和单质硫,二氧化硅不反应与单质硫一起形成矿渣,滤液中含有铁离子、铜离子,所以加入铁粉反应的反应有Fe +2Fe3+→3Fe2+ 、Fe +Cu2+→Cu+Fe2+。
(2)苯是有机溶剂,易挥发,所以温度高苯容易挥发,而温度低溶解速率小,因此回收S过程中温度控制50℃~60℃之间,不宜过高或过低。
(3)气体NOx与氧气混合后通入水中能生成硝酸,所以可循环利用的物质化学式为HNO3。滤液M是氯化亚铁,可以再转化为氯化铁而循环利用,所以该试剂应该是氯气,答案选b。
(4)氧化铜是碱性氧化物,能与酸反应调节溶液的pH值,所以氧化铜的作用是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而析出。
(5)硝酸铜溶液中的铜离子易水解,所以加入硝酸的作用是抑制Cu2+的水解;从溶液中得到硝酸铜晶体的实验操作应该是蒸发浓缩、冷却结晶。
本题难度:一般
4、选择题 相等物质的量的SO2和SO3相比较,下列结论不正确的是
A.它们的分子数目之比为1∶1
B.它们所含氧原子数目之比为2∶3
C.它们所含原子数目之比为3∶4
D.它们的质量之比为1∶1
参考答案:D
本题解析:相等物质的量的SO2和SO3的质量之比为64∶80=4∶5.
本题难度:困难
5、实验题 实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。
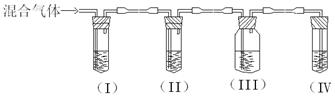
I、II、III、IV装置可盛放的试剂是:I:?II:?III:?
IV:?(请将下列有关试剂的序号填入空格内)
A.品红
B.NaOH溶液
C.浓硫酸
D.酸性KMnO4溶液