微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
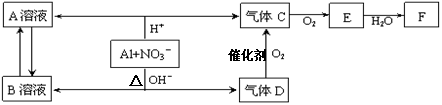
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,反应的离子方程式为?。
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C或E都转化为无毒的气态单质,任意写出其中一个反应的化学方程式?。
(3)写出铝在碱性条件下与NO3-反应的离子方程式?。
(4)除去气体C中的杂质气体E的化学方法:?(用化学方程式表示)
(5)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是?。
参考答案:(1)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分)
(2)8NH3+6NO2 7N2+12H2O 或4NH3+6NO
7N2+12H2O 或4NH3+6NO  5N2+6H2O(2分)
5N2+6H2O(2分)
(3)8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑ ?(2分)
(4)3NO2+H2O=2HNO3+NO(2分)?(5)1:1?(2分)
本题解析:
(1)A和B两溶液混合产生白色沉淀,由信息可知白色沉淀为氢氧化铝。
(2)能转化成无毒的物质,则该物质是氮气。
(3)由流程中的信息铝在碱性条件可以反应得到溶液,所以生成了偏铝酸根。
(4)杂质气体为二氧化氮,除杂时使用水即可。
(5)根据方程式,化合价升降守恒计算可得。
本题难度:一般
2、填空题 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示(部分反应条件略去)。
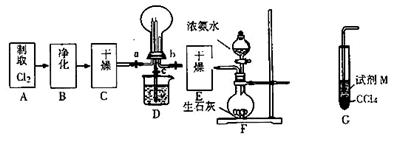
请回答下列问题:
(1)Z元素的原子结构示意图为?。
(2)A的电子式为?,D的化学式为?。
(3)E通过?反应可以生成C(填序号,有一个或多个选项符合题意)。
a.分解? b.复分解? c.氧化还原? d.置换
(4)写出下列反应的化学方程式:①?,③?。
(5)A和E化合生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为?。
参考答案:(1)? ?(2)?HNO2 ?(3)ac
?(2)?HNO2 ?(3)ac
(4)① 4NH3 + 5O2  ?4NO + 6H2O?(2分)?
?4NO + 6H2O?(2分)?
③ 2NH3 + 3O2 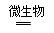 2HNO2 + 2H2O?(2分)
2HNO2 + 2H2O?(2分)
(5)NH4NO3 ="===" N2O↑ + 2H2O
本题解析:略
本题难度:一般
3、实验题 实验室常用饱和NaNO2和NH4Cl溶液反应制取纯净的氮气。反应式为:
NaNO2 + NH4Cl ="=" NaCl + N2↑+2H2O↑,该反应过程中放热。实验如下图,试回答:
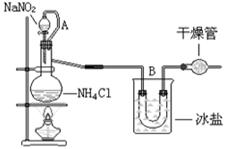
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是:________
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.NaNO2饱和溶液容易滴下
(2)B部分的作用是_________
a.冷凝? b.冷却氮气? c.缓冲氮气流
(3)加热前必须进行一个操作步骤是:?;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是:?。
(4)收集N2最适宜的方法是________
a.用排气法收集在集气瓶中? b.用排水法收集在集气瓶中? c.直接收集在球胆或塑料袋中
参考答案:(1) c ;(2)? a?;(3)检验装置气密性;?该反应是放热反应?;(4) c
本题解析:(1)导管可以保证连接的漏斗与烧瓶之间的压强相等,使液体由于重力作用而易于滴下。
(2)铵盐易分解产生HCl、NH3,通过B装置可让他们重新化合除去。
(4)氮气不溶于水,密度与空气接近,故三者相比最适宜的方法就是直接悼念在塑料袋中。
本题难度:一般
4、选择题 把 L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用 mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗 molBaCl2,则原溶液中
molBaCl2,则原溶液中 (NO
(NO )为( )
)为( )
A. mol·L-1
mol·L-1
B. mol·1-1
mol·1-1
C. mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
参考答案:B
本题解析:一份用 mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗 molBaCl2,说明每份溶液中含有SO42-是cmol,根据原子守恒可知每份溶液中硝酸铵是(b-2c)mol,所以原溶液中
molBaCl2,说明每份溶液中含有SO42-是cmol,根据原子守恒可知每份溶液中硝酸铵是(b-2c)mol,所以原溶液中 (NO
(NO )为
)为 mol·1-1。答案是B。
mol·1-1。答案是B。
本题难度:简单
5、选择题 一定质量的铁铝合金完全溶于过量的热浓硝酸中,反应中共产生13.44LNO2(标况下),若在反应后的溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量不可能为
A.7.8g
B.15.6g
C.21.4g
D.10.7g
参考答案:C
本题解析:铁铝合金与过量的热浓硝酸反应生成硝酸铁和硝酸铝,13.44LNO2(标况下)的物质的量为0.6mol,反应的过程中转移电子的物质的量为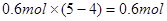 ,假设全部是由铁与热的浓硝酸反应,即参加反应的铁的物质的量为0.2mol,当加入过量的氢氧化钠后,生成的沉淀为氢氧化铁沉淀,其物质的量为0.2mol,质量为21.4g ,所以实际上生成沉淀的质量不可能为21.4g ,应小于21.4g
,假设全部是由铁与热的浓硝酸反应,即参加反应的铁的物质的量为0.2mol,当加入过量的氢氧化钠后,生成的沉淀为氢氧化铁沉淀,其物质的量为0.2mol,质量为21.4g ,所以实际上生成沉淀的质量不可能为21.4g ,应小于21.4g
本题难度:一般