微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 组成A、B、C、D分子的元素原子序数均小于10,它们之间能发生如图所示的反应.其中A的水溶液能使酚酞试夜变红,组成B的元素的电负性在周期表中最大.请写出A、B、C、D的化学式:
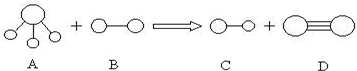
A______;B______;C______;D______.
参考答案:A的水溶液能使酚酞试夜变红,结合A的结构模型可知A为NH3,组成B的元素的电负性在周期表中最大,则B为F元素组成的单质,为F2,结合生成物的结构模型可知生成C为HF,D为N2,发生反应的方程式为2NH3+3F2=6HF+N2,
故答案为:NH3;F2;HF;N2.
本题解析:
本题难度:一般
2、简答题 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
(1)写出相应元素符合,A______B______?C______?E______
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:______.
(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为______.
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:______.
(2)写出下列反应的化学方程式
①______?②______.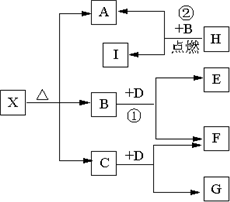
参考答案:Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的 34倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
(1)由以上分析可知,A为H,B为N,C为O,E为S,故答案为:H,N,O,S;
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,
则该盐为NaHSO3,滴入紫色石蕊试液出现红色,说明HSO3-电离程度大于水解程度,则有c(H+)>c(OH-),
溶液中还存在水的电离,则c(H+)>c(SO32-),而HSO3-电离程度较小,则c(HSO3-)>c(H+),
所以有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)将铝片和镁片.插入由A、C、D三种元素组成物质为NaOH的稀溶液中构成原电池,铝做负极失电子发生氧化反应,镁做正极,溶液中氢离子得到电子生成氢气,则负极的电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O;故答案为:2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推?知这种常见金属单质为金属镁,它在
CO2气体中燃烧生成C这种非金属单质.则A为?氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X?可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 ?可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
(1)由以上分析可知,G的化学式分别为NaOH,故答案为:NaOH;
(2)CO2与Na2O2反应生成2Na2CO3和O2,CO2与Mg反应生成MgO和C,
反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2和2Mg+CO2??点燃?.?2MgO+C,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;?2Mg+CO2??点燃?.?2MgO+C.
本题解析:
本题难度:一般
3、填空题 X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下:
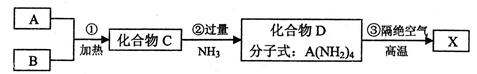
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可做光导纤维。

按要求回答下列问题:
(1)C的化学式为?;X的化学式为?。
(2)反应②的化学方程式为?。
(3)反应⑦的离子方程式?。
参考答案:(1)SiCl4 (2分)? Si3N4(2分)
(2)SiCl4+4NH3=Si(NH2)4+4HCl(3分)
(3)SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-(3分)
本题解析:(1)I可做光导纤维,所以I是二氧化硅,则F是硅酸,H是硅酸钠,因此F是单质硅。又因为F、G都是难溶于水和稀硝酸的白色沉淀,所以G是氯化银,因此C是SiCl4,则A是硅,B是氯气。根据X的性质可知,X是原子晶体,所以X是Si3N4。
(2)根据反应物和生成物可知,该反应的方程式是SiCl4+4NH3=Si(NH2)4+4HCl。
(3)CO2是过量的,因此生成物是碳酸氢钠,方程式是SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-。
本题难度:一般
4、填空题 下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟生成E,A是强碱,D的焰色为紫色 (部分反应物和生成物及水已略去)。

请回答下列问题
(1)写出工业制备B的化学方程式_____________________________________;
(2)写出常温下,A与丁反应的离子方程式________________________________;
(3)下图装置为用排空气法收集气体的实验装置

Ⅰ.当从M端通入气体时,可收集的气体有?;
Ⅱ.当从N端通入气体时,可收集的气体有 ?; (填数字编号)
①气体乙?②气体丙?③气体丁?④气体B?⑤气体C?
(4)E中所含阳离子的检验方法为(包括实验步骤、现象及结论)?;
(5)A中所含阳离子的检验方法为(包括实验步骤、现象及结论)?。
参考答案:(1)N2+3H2 2NH3(2)Cl2+2OH-=Cl-+ClO-+H2O(3)I、③⑤;Ⅱ、②④(4)加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+。(5)用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+。
2NH3(2)Cl2+2OH-=Cl-+ClO-+H2O(3)I、③⑤;Ⅱ、②④(4)加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+。(5)用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+。
本题解析:乙、丙为单质,在高温高压下催化生成B,且B与C相遇生成大量白烟,可知B为NH3,C为HCl,则丙为H2,乙为N2,丁为黄绿色气体,应为Cl2,E为NH4Cl,可与A反应生成NH3,D的焰色为紫色,应为有K+,说明A应为KOH,D为KCl,则甲为Al。
(1)工业上制备NH3在500℃,20~50MPa,在铁触媒的催化下,N2和H2合成NH3,反应方程式:N2+3H2 2NH3(2)氯气在NaOH溶液中发生反应生成氯化钠和次氯酸钠,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O(3)I、从M端用排空气发收集通入气体时,收集气体密度应大于空气密度,则M端进气,N端出气,故为③Cl2⑤HCl ;II、从N端用排空气发收集通入气体时,收集气体密度应小于空气密度,则N端进气,M端出气,故为②H2④NH3(4)E为NH4Cl,检验方法为加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+;(5)A为NaOH,用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+。
2NH3(2)氯气在NaOH溶液中发生反应生成氯化钠和次氯酸钠,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O(3)I、从M端用排空气发收集通入气体时,收集气体密度应大于空气密度,则M端进气,N端出气,故为③Cl2⑤HCl ;II、从N端用排空气发收集通入气体时,收集气体密度应小于空气密度,则N端进气,M端出气,故为②H2④NH3(4)E为NH4Cl,检验方法为加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+;(5)A为NaOH,用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+。
本题难度:一般
5、推断题 物质X、Y、Z有如下转化关系
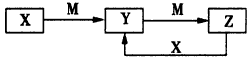
请回答下列问题:
(1)若X、Y、Z均为含铝元素的化合物,M的化学式可以是__________________。
(2)若M是第ⅣA族某元素的最高价氧化物,且M为气体,组成X的阴阳离子均含有10个电子。Y溶液中离子浓度大小顺序为:__________________。
(3)若X是一种黄绿色气体,M是一种常见金属。写出Z→Y的离子方程式:_____________________。
(4)若X、Y、Z中都含有硫元素,已知下列两个热化学方程式:
X转化为Y:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-Q1kJ/mol;
X转化为Z:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=- Q2 kJ/mol
请写出X与Z反应转化为Y的热化学方程式:_____________________。
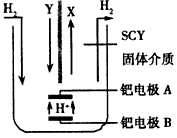
(5)若X、Y、Z中均含有N元素,则在常压下把氢气和用氦气稀释的Y气体,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜作电极,电解可合成X气体(装置如图)。
①则在电解法合成X的电解池中_______(填“能”或“不能”)用水作电解质溶液的溶剂。钯电极A是电解池的______极(填“阳”或“阴”);
②该极上的电极反应式是______________。
参考答案:(1)NaOH或HCl(或其他合理答案)
(2)c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-(3Q1- Q2)/2 kJ/mol
(5)①不能;阴;②N2+6e-+6H+=2NH3
本题解析:
本题难度:一般