微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Cu和稀HNO3反应时,Cu被HNO3氧化成Cu(NO3)2,又知该反应中氧化剂和还原剂个数之比是2∶3。该反应中HNO3的还原产物是(? )
A.NO2
B.NO
C.N2
D.NH4NO3
参考答案:B
本题解析:依据化合价升降总数相等,还原剂是Cu,氧化产物是Cu(NO3)2,假设还原剂个数为3个,共升高3×2=6价。那么氧化剂为2个,降价总数也为6价,HNO3为氧化剂,从+5价降低到+2价,还原产物中N元素化合价为+2。
本题难度:简单
2、选择题 对于Fe+2HCl=FeCl2+ H2↑反应,下列说法不正确的是(?)
A.Fe是还原剂,被氧化
B.HCl是氧化剂,发生了还原反应
C.-1价氯在反应中价态未变,所以HCl既不是氧化剂,又不是还原剂
D.此反应既是置换反应又是氧化还原反应
参考答案:C
本题解析:A 正确,铁的化合价升高,失电子,是还原剂,被氧化。
B 正确,氢元素化合价降低,得电子,是氧化剂,被还原,发生了还原反应。
C 错误,HCl是还原剂。
D 正确,既是氧化反应也是置换反应。
故选C
本题难度:一般
3、填空题 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:
2Fe3++2e-= 2Fe2+。
据此,回答下列问题:
(1)将反应Zn+2H+ === Zn2++H2↑拆写为两个“半反应式”: 氧化反应式:____________________,
还原反应式:__________________。
(2)已知某反应的两个“半反应式”为:CH4+10OH--8e-=CO32-+7H2O,O2+2H2O+4e-=4OH-,则氧化还原反应方程式为____________________。
参考答案:(1)Zn-2e-==Zn2+;2H++2e-==H2↑
(2)CH4+2O2+2OH-==CO32-+3H2O
本题解析:
本题难度:一般
4、填空题 某厂废水中含5.00×10-3mol·L-1的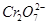 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
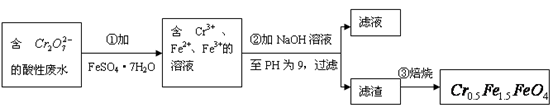
(1)第①步反应的离子方程式是?
(2)第②步中用PH试纸测定溶液PH的操作是:
?
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有?
(4)欲使1L该废水中的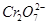 完全转化为
完全转化为 。理论上需要加入?
。理论上需要加入?
GFeSO4·7H2O。
参考答案:
(1)Cr2O72- + 6Fe2+ + 14H+ 2Cr3+ + 6Fe3+?+ 7H2O
2Cr3+ + 6Fe3+?+ 7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照
(3)Fe(OH)3、Fe(OH)2
(4)13.9
本题解析:(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(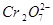 )=5.00×10-3mol,根据关系式:
)=5.00×10-3mol,根据关系式: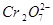 ~4Cr0.5Fe1.5FeO4~
~4Cr0.5Fe1.5FeO4~
10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol
本题难度:一般
5、选择题 若某反应的方程式为:A+酸===盐+水,则A不可能属于( )
A.氧化物
B.碱
C.单质
D.电解质
参考答案:C
本题解析:单质和酸反应不可能是盐和水,其余都是可能的,答案选C。
本题难度:一般