|
高中化学知识点讲解《元素周期律》高频试题巩固(2017年最新版)(十)
2017-03-03 00:50:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)自来水厂用氯气进行消毒,改善水质,因为氯气与水反应会生成盐酸和次氯(HClO)次氯酸具有杀菌消毒作用,其反应方程式为:
?。
(2)氯气与氢氧化钙溶液反应能制得漂白粉(次氯酸钙与氯化钙的混合物)。试写出反应的化学方式:?。
(3)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
NO对环境的危害在于??(填以下项目的编号)
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合
| ②在含Cu+ 离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+ 和亚硝酸根离子在酸性水溶液中反应的离子方程式:
。
参考答案: (1)反应方程式为:Cl2+H2O=HCL+HClO?。(3分)
(2)化学方程式为:2Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+2H2O?。(3分)
(3)①? ACD?(3分)
②_2H+ +Cu+ NO2—= NO↑+Cu2+ + H2O __(3分)
本题解析:本题考查了非金属Cl、N的有关知识,题目较容易。
(1)氯气溶于水的反应方程式为:Cl2+H2O=? HCl? + HClO
(2)氯气与氢氧化钙反应的方程式为:2Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3)①NO遇到空气中中的氧气会立即发生下列反应:2NO+O2=2NO2,NO2与空气的水分反应生成硝酸,从而造成酸雨;人类过多地使用氯氟烃类化学物质是破坏臭氧层的主要原因,臭氧层中存在着氧原子(O)、氧分子(O2)和臭氧(O3)的动态平衡。但是氮氧化物等活性物质及其他活性基团会破坏这个平衡,使其向着臭氧分解的方向转移,所以,氮氧化物也是造成臭氧空洞的一个因素;NO与CO一样能与血红蛋白结合,并且不易分离,从而导致人体缺氧窒息中毒。答案:ACD。
②根据题目信息,H+、Cu+、NO2-?发生氧化还原反应,由于 NO2-变为 NO发生了还原反应,则Cu+发生氧化反应变为Cu2+,然后根据原子守恒、电荷守恒则得:
2H+ +Cu++ NO2—= NO↑+Cu2+ + H2O
【点评】此题为信息题。读懂题目所给信息是解决此题的关键。比如:“亚硝酸根离子在酸性”提醒反应物种必有H+离子参加等。
本题难度:一般
2、推断题 (三选一)【物质结构与性质】
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式:________, F位于周期表____区。
(2)A、B、C的第一电离能由小到大的顺序为____。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
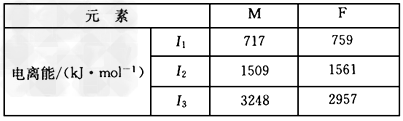
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是_____________________
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为________,一个晶胞中F原子的数目为_________。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下
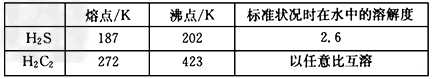
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是____________
参考答案:(1)1s22s22p63s23p63d64s2;d
(2)C<O<N
(3)Mn2+的3d轨道电子排布为半满状态,较稳定
(4)8;2
(5)H2O2分子间能形成氢键,也可与水分子形成氢键
本题解析:
本题难度:一般
3、填空题 (1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式?;?。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是?(用化学方程式表式)
(3)向100ml水中投入Na和Al共16克,充分反应后分析剩余金属1g。计算放出H2的体积为?升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为?mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml)?mol/L
参考答案:(1)Na2CO3+SiO2 Na2SiO3+CO2↑,CaCO3+SiO2 Na2SiO3+CO2↑,CaCO3+SiO2 CaSiO3+CO2↑?(4分)(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3(其它合理也给分) CaSiO3+CO2↑?(4分)(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3(其它合理也给分)
(3)13.44?(4)100或900?(5)2.17mol·L-1
本题解析:(1)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,该反应的化学方程式为:Na2CO3+SiO2 Na2SiO3+CO2↑,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2 Na2SiO3+CO2↑,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2 CaSiO3+CO2↑;(2)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的; CaSiO3+CO2↑;(2)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的;
(3)Na不会剩余,所以剩余金属为Al。设混合物中Na的物质的量为,Al的物质的量为y。
2Na+2H2O=2NaOH+H2↑
x? x? x/2
因为剩余金属为Al,说明过量,氢氧化钠少量,用少的来计算
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
x ?x ?3x/2?
23x+27x=16-1? x=0.3mol?氢气的体积为(x/2+3x/2 )mol×22.4L/mol=13.44L
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,生成的沉淀是氢氧化铝,7.8克氢氧化铝是0.1mol,分两种情况,一是盐酸少量,过量的AlO2-只跟少量的HCl反应生成了0.1molAl(OH)3
AlO2-+H++H2O=Al(OH)3↓
0.1mol? 0.1mol
所以V?(HCl)= =100mL =100mL
还有一种情况是全部转化为Al(OH)3,然后Al(OH)3又跟H+反应溶解,变成Al3+,Al(OH)3没有反应完,最后剩余0.1mol
AlO2-+H++H2O=Al(OH)3↓
0.3mol? 0.3mol?0.3mol?
Al(OH)3? +? 3H+=Al3+ + 3H2O
(0.3mol-0.1mol) =0.2mol? 0.6mol?
所以V?(HCl)= =900mL =900mL
(5)与氢氧化钠反应的硫酸的物质的量= n(NaOH)= n(NaOH)= ×2mol·L-1×0.04L=0.04mol, ×2mol·L-1×0.04L=0.04mol,
剩余的硫酸的物质的量=2.2mol·L-1×0.12L-0.04mol=0.264mol-0.04mol=0.26mol,剩余硫酸与固体反应生成了硫酸亚铁,
根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度.
设硫酸亚铁的物质的量浓度为cmol·L-1.
H2SO4→FeSO4
1mol? 1mol
0.26mol 0.12L×cmol·L-1
c=2.17
即硫酸亚铁的物质的量浓度是2.17mol·L-1,
本题难度:一般
4、选择题 下列反应所得的溶液中一定只含一种溶质的是(? )
A.向硫酸酸化的Fe2(SO4)3溶液中加入过量的Ba(OH)2溶液
B.向AlCl3溶液中加入过量的氨水
C.向NaOH溶液中通人CO2气体
D.将过量的Cu粉加入FeCl3溶液
参考答案:A
本题解析:A中最后的溶质为Ba(OH)2,Fe2(SO4)3与H2SO4都已经反应完。B选项中最后的溶质为氯化铵
与一水合氨。C选项中一开始生成碳酸钠,当二氧化碳过量后,还会继续生成碳酸氢钠。D中铜与氯化铁
反应生成氯化铜和氯化亚铁。
点评:本题需学生熟练掌握物质之间的反应,属于容易题。
本题难度:一般
5、选择题 下图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是(?)

?
| A
| B
| C
| D
| 喷洒液
| 酚酞
| 紫色石蕊
| 酸性高锰酸钾
| 酸化的淀粉?KI
| 通入的气体
| NH3
| Cl2
| CH2=CH2(g)
| NO2
| 预测的颜色变化
| 变为红色
| 最终褪色
| 褪色
| 无明显变化
|
?
参考答案:D
本题解析:NO2气体能把I-氧化成I2,应变蓝色,D项不一致。
本题难度:一般
|