微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学实验操作合理的是( )
①在配制FeSO4溶液时常向其中加入一定量铁粉和稀硫酸
②配制100 mL 1.00 mol/L的NaCl溶液时,可用托盘天平称取5.85 g NaCl固体
③物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
④用试管夹从试管底由下往上夹住距试管口约1/3处,手持试管夹长柄末端,进行加热
⑤不慎将浓硫酸沾在皮肤上,立即用NaHCO3溶液冲洗
⑥用广泛pH试纸测得某溶液的pH=12.3
⑦用碱式滴定管量取20.00 mL 0.100 0 mol/L KMnO4溶液
⑧将铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜
A.④⑤⑥⑦
B.①④⑤⑦
C.②③⑥⑧
D.①③④⑧
参考答案:D
本题解析:①为防止FeSO4被氧化和抑制Fe2+的水解,在配制FeSO4溶液时需要向其中加入一定量铁粉和稀硫酸,①正确;②托盘天平只能精确到0.1 g,②错误;③正确;④正确;⑤浓硫酸沾在皮肤上,应先用干抹布擦掉,再用大量水冲洗,最后涂上NaHCO3溶液,⑤错误;⑥广泛pH试纸只能精确到整数部分,⑥错误;⑦碱式滴定管不能用来量取具有氧化性的KMnO4溶液,⑦错误;⑧将铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜可以避免产生SO2,⑧正确。综上所述,D正确。
本题难度:一般
2、选择题 下列能达到实验目的且符合安全要求的是(? )
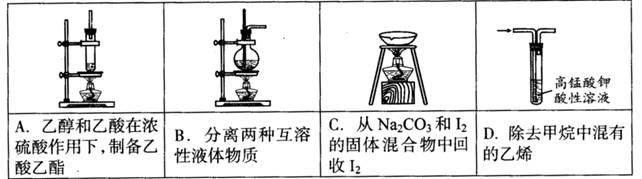
参考答案:A
本题解析:A、塞子上的玻璃管能起冷凝回流作用,正确;B、根据沸点不同,可用蒸馏法,但必须用蒸馏烧瓶,且温度计水银在支管口附近,错误;C、回收碘单质不能用敞口加热,碘单质会升华,无法收集,错误;D、乙烯与KMnO4作用生成CO2引入新的杂质,错误。
本题难度:一般
3、填空题 下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
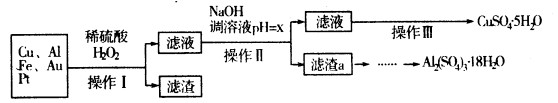
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Cu(OH)2
|
开始沉淀
| 1.1
| 4.0
| 5.4
|
完全沉淀
| 3.2
| 5.2
| 6.7
|
?
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:?.。
(2)在操作Ⅱ中,x的取值范围是??。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有??。
(4)由滤渣a制取Al2(SO4)3·l8H2O,探究小组设计了三种方案:
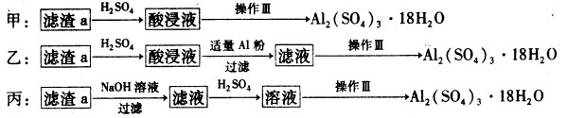
综合考虑上述三种方案,最具可行性的是?(填序号)。
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 ?。
②下列滴定方式中,最合理的是(夹持部分略去) ?(填序号)。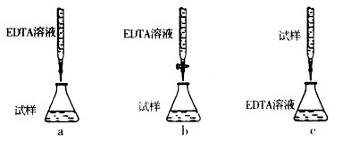
参考答案:(1)Cu+H2O2+H2SO4=CuSO4+2H2O;(2)5.2≤x<5.4;(3)酒精灯、玻璃棒、蒸发皿(有玻璃的);(4)乙;(5)①15b/a×100%;②b。
本题解析:根据题给信息知,该流程是利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体;分析题给流程图知,Cu、Al、Fe、Au、Pt与稀硫酸和H2O2的混合液反应生产硫酸铜、硫酸铝和硫酸铁的混合液,过滤后得滤渣为Au、Pt;滤液用氢氧化钠溶液调节PH的目的为将铝离子和铁离子转化为氢氧化铁和氢氧化铝沉淀而除去,过滤得硫酸铜溶液,经蒸发浓缩、冷却结晶、过滤得硫酸铜晶体;(1)Cu与稀硫酸和H2O2的混合液反应生成硫酸铜和水,化学方程式为:
Cu+H2O2+H2SO4=CuSO4+2H2O;(2)在操作Ⅱ中,用氢氧化钠溶液调节PH的目的为将铝离子和铁离子转化为氢氧化铁和氢氧化铝沉淀而除去,根据题给数据知x的取值范围是5.2≤x<5.4;(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有酒精灯、玻璃棒、蒸发皿(有玻璃的);(4)滤渣a为氢氧化铁和氢氧化铝的混合物,利用其制取Al2(SO4)3·l8H2O,甲方案制得产品中含有杂质硫酸铁,丙方案制得的产品中含有杂质硫酸钠,最具可行性的是乙;(5)①根据题给信息得关系式:CuSO4·5H2O——H2Y2-,代入题给数据计算得CuSO4·5H2O晶体的纯度是 15b/a×100%;②根据题给信息知,试样和EDTA均为酸性,应用酸式滴定管,选b。
本题难度:一般
4、实验题 (10分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):若移液后没有洗涤烧杯?;若加蒸馏水时不慎超过了刻度线?;若定容时俯视刻度线___________________;若量取浓盐酸仰视读数?。另外若定容时加蒸馏水不慎超过了刻度线应如何处理?。
参考答案:偏低;偏低;偏高;偏高。重新配制
本题解析:
考查配制一定量的物质的量浓度溶液时的误差分析,及基本操作。
若移液后没有洗涤烧杯,溶质损失,浓度偏低;若加蒸馏水时不慎超过了刻度线溶液体积变大,浓度偏低;若定容时俯视刻度线定容时加入的水不足,浓度偏高;若量取浓盐酸仰视读数取出的溶质偏多,浓度偏高。另外若定容时加蒸馏水不慎超过了刻度线应如何处理操作失败,应重新配制。
本题难度:简单
5、选择题 下图是 10ml 量筒的一部分,数字XY之间相差 1ml,若 X=5,则量筒所盛液体的体积是
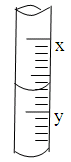
A.5.7 ml
B.4.4 ml
C.4.3 ml
D.6.3 ml
参考答案:C
本题解析:若 X=5,Y=4,每小格0.1mL,所以读数为4.3 ml,选C。
本题难度:简单