微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
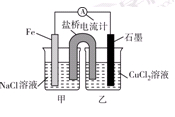
1、选择题 下图是研究铁钉腐蚀的装置图,下列说法不正确的是
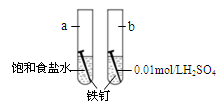
A.铁钉在两处的腐蚀速率:a < b
B.a、b两处铁钉中碳均正极
C.a、b两处铁钉中的铁均失电子被氧化
D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O
参考答案:D
本题解析:A、b中的氢离子浓度较大,所以腐蚀速率b>a,正确;B、ab中都发生原电池反应,铁钉中的碳作正极,铁作负极,正确;C、铁作负极,发生氧化反应,失电子,正确;D、a中发生吸氧腐蚀,正极反应是O2+4e-+2H2O ="4" OH-;b中发生析氢腐蚀,正极反应是2H++2e-==H2↑;错误,答案选D。
本题难度:一般
2、选择题 LiFePO4电池具有稳定性高、安全、环保等优点,可用于电动汽车。电池反应为:
FePO4+Li 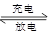 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向正极移动
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
参考答案:A
本题解析:由题可以知道该电池的电解质为固体电解质,所以不可加入硫酸以提高电解质的导电性,故A错误,为本题的答案;由电池反应FePO4+Li 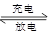 LiFePO4可以知道,放电时电池内部Li+向正极移动,故B正确;充电过程中,电池正极材料的质量减少,故C正确;放电时电池正极反应为:FePO4+Li++e-=LiFePO4,故D正确。
LiFePO4可以知道,放电时电池内部Li+向正极移动,故B正确;充电过程中,电池正极材料的质量减少,故C正确;放电时电池正极反应为:FePO4+Li++e-=LiFePO4,故D正确。
点评:本题考查了结合原电池的知识考查了LiFePO4电池,起点高,注意本题要利用好本题的题干的信息,该题有一定的难度。
本题难度:一般
3、选择题 下列有关金属腐蚀与防护的说法正确的是
A.金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生
B.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈
C.钢铁发生析氢腐蚀时,正极发生的电极反应为:Fe-2e-?Fe2+
D.埋在地下的钢管与电源正极连接可以减缓腐蚀
参考答案:A
本题解析:B不正确,发生吸氧腐蚀时,氧气在正极得到电子;铁作负极,负极发生的电极反应为:Fe-2e-?Fe2+,C不正确;铁和电源的正极相连,作阳极,失去电子,加速腐蚀,D不正确,答案选A。
点评:金属腐蚀主要是以电化学腐蚀为主。而在电化学腐蚀中,又主要以吸氧腐蚀为主。但不论是吸氧腐蚀,还是析氢腐蚀,金属都是作负极失去电子,据此可以进行有关判断,该题难度不大。
本题难度:一般
4、选择题 某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合时,阴离子交换膜处的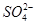 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
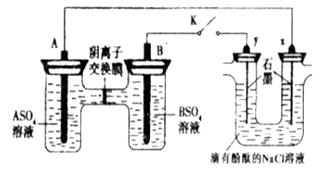
A.A的金属活动性弱于B
B.Na+从y电极趋向x电极
C.Y电极附近溶液先变红
D.B的电极反应: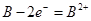
参考答案:B
本题解析:根据题意知,该装置中右边装置为电解池,左边装置是原电池;A、当K闭合时,阴离子交换膜处SO42-从右向左移动,说明A为负极,B为正极,则A的金属活动性强于B,错误; B、右边装置中连接B的y极为阳极,连接A的x极为阴极,电解池工作时,Na+从y电极趋向x电极,正确; C、右边装置中y极上发生的电极反应式为2Cl--2e-=Cl2↑,x极上发生的电极反应式为2H++2e-=H2↑,由于氢离子放电而氢氧根离子不放电导致溶液呈碱性,X电极附近溶液先变红,错误;D、当K闭合时,阴离子交换膜处SO42一从右向左移动,说明A为负极,B为正极,B极上溶液中的金属阳离子得电子生成金属单质,电极反应式为B2++2eˉ═B,错误。
本题难度:一般
5、填空题 (10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。

Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题:
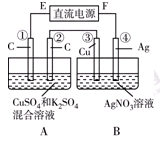
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
参考答案:Ⅰ.(1)Fe+Cu2+=Fe2++Cu ? 0.2
(2)2H++2e-=H2↑? 酸性? NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(3) 阴? 2Cl--2e-=Cl2↑
Ⅱ.(1)①0.005? ②Cu2++2e-=Cu 2H++2e-=H2↑(共1分) ?③0.025
本题解析:Ⅰ.由图可知该装置为原电池,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu?两极质量差△m?转移电子
56g? 64g? 56g+64g=120g? 2mol
12g? n
n=0.2mol
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,发生:NH4++H2O?NH3?H2O+H+,负极发生2H++2e-═H2↑,负极发生Fe-2e-=Fe2-。
(3)将盐桥换成弯铜导线与石墨相连成n型,则甲装置为原电池,铁做负极,铜为正极。乙装置为电解池,石墨(1)为阴极,乙装置中与铜线相连石墨电极为阳极。发生的反应式为2Cl--2e-=Cl2↑
Ⅱ.由图可知,B装置为电解池,第③极增重2.16g,发生Ag++e-=Ag,n(Ag)=0.02mol,则转移电子为0.02mol,
A池中收集到标准状况下的气体224mL,所以气体的物质的量为0.224L/22.4L/mol=0.01mol,
A装置中阳极发生4OH--4e-=O2↑+2H2O,转移0.02mol电子。第②极生成气体为0.005mol,
所以第①极上发生反应的电极反应式为
2H++2e-=H2↑,
0.01?0.005
Cu2++2e-=Cu
0.005 0.01
即Cu2+的物质的量为(0.02?0.005×2)/ 2=0.005mol,
c(Cu2+)=0.005mo/l0.2L=0.025mol/L。
本题难度:一般