微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是用来说明金属的吸氧腐蚀的简易装置,有关此装置的叙述中错误的是?
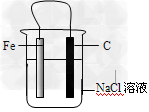
[? ]
A.铁片为负极,碳棒为正极 ?
B.铁被腐蚀,碳棒上有氯气放出 ?
C.碳棒附近的溶液可使酚酞变红 ?
D.导线上有电流通过,电流方向是由碳极流向铁极
参考答案:B
本题解析:
本题难度:一般
2、选择题 以铝为阳极,Cu为阴极,对200ml NaOH、Na2SO4各为1mol/L的混合溶液进行电解,当电解一段时间并充分振荡、静止、过滤后得到深沉的质量为7.8g,则阳极溶解的Al的质量为(?)
A.2.7g
B.5.4g
C.8.1g
D.10.8g
参考答案:B
本题解析:当溶液中有NaOH存在时,电解总反应为2Al+2H2O+2OH-=2AlO2-+3H2↑;当溶液中NaOH消耗完后,电解总反应为2Al+6H2O=2Al(OH)3↓+3H2↑。由此可知NaOH消耗前溶解Al为0.2mol,NaOH消耗后溶解Al为0.1mol。
本题难度:一般
3、简答题 人类的生活离不开化学,生活中的化学无处不在.请回答:
(1)家用铁锅用水清洗后放置一段时间,出现红棕色的锈斑.此过程中不可能发生的变化有______(填序号).
①铁元素被氧化②铁元素被还原③铁元素由+3价转化为+2价
为防止铁锅生锈,将其洗净后,可进一步采取的措施是______(填序号).
①擦干②放在潮湿的地方
(2)抗酸药物的作用是中和胃里过多的盐酸.某抗酸药的主要成分是碳酸氢钠,写出碳酸氢钠与盐酸反应的离子方程式:______.若此抗酸药每片含碳酸氢钠0.40g,取此药一片研碎后与足量的盐酸反应,生成气体在标准状况下的体积为______L(精确到0.01).
参考答案:(1)铁锅中含有碳、铁,碳、铁和合适的电解质溶液构成原电池,较活泼的金属铁作负极,碳作正极,铁失电子发生氧化反应,氧气得电子发生还原反应,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定被氧气氧化生成氢氧化铁,所以不可能发生的变化是②③,为防止形成原电池,要擦干,故选①;
故答案为:②③,①;
(2)碳酸氢钠和盐酸反应的离子方程式为:HCO3-+H+=C02↑+H2O,
根据HCO3-+H+=C02↑+H2O知,生成二氧化碳的体积=0.4g84g/mol×22.4L/mol=0.11L,
故答案为:HCO3-+H+=C02↑+H2O,0.11.
本题解析:
本题难度:简单
4、简答题 如图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物.
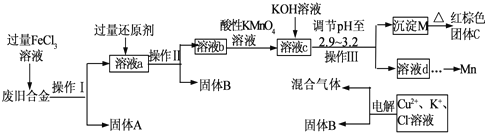
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是______.
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:______.
(3)过量的还原剂应是______.
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为______.
②若用Xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为______g(用含X、Y的代数式表示).
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:______.(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为______L(用含Z的代数式表示);该电极的反应式为______.
参考答案:(1)通过操作Ⅰ、Ⅱ、Ⅲ都得到固体和溶液,所用该操作是过滤,过滤是把不溶性固体和溶液分开的操作,
故答案为:过滤;
(2)FeCl3具有氧化性,会把铁、铜氧化,反应方程式为:2FeCl3+Fe=3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2,
故答案为:FeCl3+Fe=3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2;
(3)根据流程最后滤液中含铜,加入过量的还原剂目的是还原过量的氯化铁,故应加铜,故答案为:铜粉;
(4)①溶液b中含亚铁离子,会被酸性高锰酸钾氧化成铁离子,高锰酸钾被还原为锰离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②根据关系式计算:
2 MnO4-~10Fe2+~5Fe2O3
2105×160g
0.001XYm
m=0.001XY×5×160g2=0.4XY,
故答案为:0.4XY;
(5)因Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
溶度积常数越小,对应离子越易沉淀,故沉淀顺序为:Fe3+>Cu2+>Mn2+,
故答案为:Fe3+>Cu2+>Mn2+;
(6)由流程可知,电解氯化铜得到铜和氯气,生成Zg 铜转移电子数为:Zg64g/mol×2=Z32mol,生成氯气:Z64mol,要使两极得到气体体积相同,则还要电解水,设电解水的物质的量为x,根据反应式:2H2O通电.H2↑+O2↑可知,生成xmol氢气和0.5xmol氧气,根据两极气体体积相等可列出方程:Z64mol+0.5xmol=xmol,解得x=Z32,故生成氧气的物质的量为:Z64mol,标况下体积为:Z64mol×22.4L/mol=22.4Z64L,生成氧气的电极反应式为:4OH--4e-=O2↑+4H2O,
故答案为:22.4Z64;4OH--4e-=O2↑+4H2O.
本题解析:
本题难度:一般
5、选择题 相同材质的铁在下列情形下最不易被腐蚀的是
[? ]
A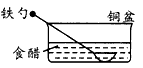
B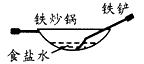
C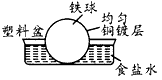
D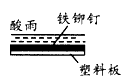
参考答案:C
本题解析:
本题难度:简单