微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某原子中的第x电子层,当把它作为最外层时,容纳的电子数最多与x-1层相同;作为次外层时,最多容纳的电子数比x+1层多10,则x层可能为
[? ]
A.第1层
B.第2层
C.第3层
D.任意层
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列各微粒中,核外电子总数相等的是( )
A.N2和CO
B.H2S和H2O
C.NH4+和H2S
D.CO2和NO2
参考答案:A、N2核外电子总数为14,CO核外电子总数为6+8=14,核外电子总数相等,故A符合;
B、H2S核外电子总数为2+16=18,H2O核外电子总数为2+8=10,核外电子总数不相等,故B不符合;
C、NH4+核外电子总数为7+4-1=10,H2S核外电子总数为2+16=18,核外电子总数不相等,故C不符合;
D、CO2核外电子总数为6+16=22,NO2核外电子总数为7+16=23,核外电子总数不相等,故D不符合.
故选:A.
本题解析:
本题难度:一般
3、填空题 (1)
O2-中的质子数是______,中子数是______,核外电子数是______,质量数是______,画出此微粒的离子结构示意图:______
(2)写出下列元素的电子排布式
A题:
某原子3p轨道上得到1个电子后不能再容纳外来电子,其基态原子的电子排布式为:______
某元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为:______
B题:
Mg:______K:______Cr:______(以原子实表示法表示).
(3)画出下列元素的轨道表示式:C:______N:______.
参考答案:(1)?188O2-中的质子数是8,质量数是18,;质子数+中子数=质量数,所以其中子数为10,阴离子的电子数=质子数+电荷数.所以其电子数为10,离子结构示意图为:
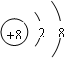
,故答案为:8;8;10;
;
(2)A题:根据核外电子排布规律,该基态原子的电子排布式为:1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2,为Fe,故答案为:1s22s22p63s23p63d64s2;
B题:Mg用原子实表示为:[Ne]3s2,K用原子实表示为:[Ar]4s1,Cr用原子实表示为:[Ar]3d54s1,故答案为:[Ne]3s2;[Ar]4s1;[Ar]3d54s1.
(3)C原子基态时的电子排布式为1s22s22p2,其电子的轨道表示式为:
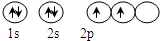
;
N原子基态时的电子排布式为1s22s22p3,其电子的轨道表示式为:
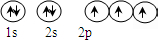
,
故答案为:

;

.
本题解析:
本题难度:一般
4、选择题 有Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则下列分析中不正确的是( )
A.粒子半径大小的关系是Xn->Yn+、X<Y
B.Z是稀有气体原子
C.原子核电荷数:Z>Y>X
D.Xn-、Yn+、Z的核外电子数相同
参考答案:Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,最外层电子数为8,X与Z同周期,Y在它们的下一周期,三种粒子其原子序数关系应为:Y>Z>X,核外电子排布相同,原子序数越小的离子半径越大.
A、具有相同电子层结构的离子,核电荷数越大,离子半径越小,阳离子Yn+的半径应小于阴离子Xn-,X与Z同周期,Y在它们的下一周期,原子半径Y>X,故A正确;
B、Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,最外层电子数为8,Z一定是稀有气体元素,故B正确;
C、Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,原子核电荷数:Y>Z>X,故C错误;
D、Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,故D正确.
故选C.
本题解析:
本题难度:一般
5、选择题 化合物N5AsF6中含有高能量的阳离子N5+,下列有关叙述错误的是( )
A.1个N5+阳离子共有34个核外电子
B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As元素的化合价为+1
D.化合物N5AsF6中F元素的化合价为-1
参考答案::A、N5+核外电子数为7×5-1=34,故A正确;
B、N元素是非金属元素,同种非金属元素原子之间以共价键结合,N5+中氮原子间以共价键结合,故B正确;
C、化合物中氟元素化合价为-1价,N5的化合价+1价,所以As的化合价为0-1-6×(-1)=+5,故C错误;
D、氟元素非金属性很强,没有正化合价,氟原子最外层有7个电子,化合物N5ASF6中F的化合价为-1价,故D正确.
故选:C.
本题解析:
本题难度:一般