微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数。A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是
[? ]
A.B元素原子的电子排布式为1s22s22p63s23p5
B.化合物AB的电子式为
C.化合物AB的电子式为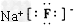
D.A与水反应的离子方程式为Na+H2O= OH-+Na++H2↑
参考答案:C
本题解析:
本题难度:一般
2、选择题 F2和Xe在一定条件下可生成XeF2、XeF4和?XeF6三种氟化氙,它们都是极强的氧化剂,下列关于Xe的氟化物的叙述不正确的是( )
A.XeF2分子中Xe原子最外层不是八电子结构
B.XeF2、XeF4和XeF6的固态均是分子晶体
C.熔点大小顺序XeF2<XeF4<XeF6
D.Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
参考答案:D
本题解析:
本题难度:简单
3、填空题 [化学--物质结构与性质
Ⅰ.(1)原子数相同,价电子数也相同的微粒,称为等电子体.等电子体具有相似的化学键特征,性质相似.CO的结构式为______.
Ⅱ.(2)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、航天航空材料,被誉为“未来世界的金属”.?钛的基态原子的电子排布式为______.
(3)偏钛酸钡在小型变压器、话筒和扩音器中都有●Ti应用.偏钛酸钡为离子晶体,晶胞的结构如图?所示,它的化学式是______.
(4)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为l?mol,已知该配合物的配位数为6,则该配合物的配位体是______.1mol该配合物外界所含?结晶水的物质的量为______mol.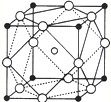
参考答案:Ⅰ.(1)CO与N2为等电子体,已知N2的结构式为N≡N,等电子体具有相似的化学键特征,则CO的结构式为C≡O,故答案为:C≡O;
Ⅱ.(2)Ti的原子序数为22,根据能量最低原理和洪特规则,Ti的电子排布式为1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(3)根据晶胞的结构,利用均摊法计算,晶胞中含有一个Ba2+,位于晶胞的体心,而Ti4+位于顶点,则晶胞平均含有Ti4+的个数为8×18=1,O2-位于棱,平均一个晶胞含有O2-的个数为12×14=3,所以化学式为BaTiO3,故答案为:BaTiO3;
(4)将1molTiCl3(H2O)6溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为lmol,说明外界Cl-为1mol,则有2molCl-与Ti3+形成配位键,已知该配合物的配位数为6,则有4molH2O与Ti3+形成配位键,1mol该配合物外界所含结晶水的物质的量为2mol,
故答案为:Cl-、H2O;2.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.4.0g碳化硅晶体中所含C-Si数为0.4NA
B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构
C.电解精炼铜时,当阳极质量减少3.2?g时,电路中转移的电子数为0.1NA
D.若H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ?mol-1,则含Ba(OH)2?1?mol溶液与1?mol稀H2SO4反应放出的热量为114.6?kJ
参考答案:A、4.0g碳化硅晶体的物质的量为4g40g/mol=0.1mol,每个C原子掌握有4个Si原子,每个Si原子掌握有4个C原子,每个C原子呈4个C-Si键,所以含有的C-Si键数目为0.1mol×4×NAmol-1=0.4NA,故A正确;
B、PCl3中各原子满足8电子结构,BF3中B原子、HClO中H原子不满足8电子稳定结构,故B错误;
C、电解精炼铜时,阳极失电子的物质除铜外,其它部分杂质也发生氧化反应,当阳极质量减少3.2?g时,电路中转移的电子数不一定为0.1NA,故C错误;
D、Ba(OH)2?1?mol溶液与1?mol稀H2SO4反应生成2mol水与1mol硫酸钡沉淀,生成硫酸钡沉淀也放出热量,所以放出的热量应大于114.6?kJ,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 下列说法中错误的是( )
A.电子排布式1s22s22p63s23p63d3违反了能量最低原理
B.6C的电子排布式1s22s22px2违反了洪特规则
C.同一原子中一定没有能量相同的电子
D.电子排布式1s22s22p63s23p10违反了泡利原理
参考答案:C
本题解析:
本题难度:一般