微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是
A 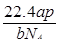 ?B
?B 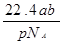
C 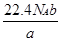 ?D
?D 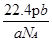
参考答案:D
本题解析:双原子分子的物质的量= ?mol,
?mol,
双原子分子的摩尔质量= ?g·mol-1,
?g·mol-1,
所以,b g气体在标准状况下的体积为,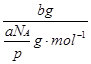 ×22.4 L·mol-1=
×22.4 L·mol-1= 。
。
本题难度:一般
2、计算题 (共8分)常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。
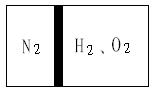
(1)求反应前H2和O2的物质的量之比。
(2)求反应前H2和O2混合气体的平均相对分子质量。
参考答案:(1)4:5? (2)18.7
本题解析:略
本题难度:简单
3、计算题 有一瓶100ml硫酸和硝酸的混合溶液,取出10.00ml该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,得4.66g沉淀。滤液跟2.00mol/L的NaOH溶液反应共用去35.00mlNaOH溶液时恰好使溶液呈中性,则混合酸中硫酸和硝酸的物质的量的浓度是多少?
参考答案:c(H2SO4)=2.00mol/L?c(HNO3)=3.00mol/L
本题解析:硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g的沉淀为硫酸钡,根据n=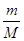 计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与2.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=
计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与2.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=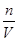 计算硫酸、硝酸的物质的量浓度。
计算硫酸、硝酸的物质的量浓度。
解:硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g的沉 淀为硫酸钡,硫酸根守恒,故n(H2SO4)=n(BaSO4)=4.66g÷233g/mol=0.02mol
故原溶液中c(H2SO4)=0.02mol÷0.01L=2.00mol/L
滤液中氢离子物质的量不变,与2.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应
故n(HNO3)+2(H2SO4)=n(NaOH)
即n(HNO3)+2×0.02mol=0.035L×2mol/L
解得n(HNO3)=0.03mol
所以原溶液中c(HNO3)=0.03mol÷0.01L=3.00mol/L,
本题难度:一般
4、选择题 浓度为2mol/L的盐酸溶液V?L,欲使其浓度变为4mol/L,下列方法可行的是( )
A.通入标况下的HCl气体44.8?L
B.将溶液加热蒸发浓缩至0.5V
C.加入10?mol/L盐酸0.6V?L,再将溶液稀释至2V?L
D.蒸发掉0.5?L水
参考答案:A、标况下的HCl气体44.8L物质的量为2mol,通入VL2mol/L的盐酸中,溶液中HCl的物质的量为(2V+2)mol,但溶液的体积不一定是0.5(V+1),故A错误;
B、加热蒸发HCl挥发,溶液浓度降低,故B错误;
C、混合后溶液中的HCl为2mol/L×VL+10mol/L×0.6VL=8Vmol,所以混合后HCl的浓度为8Vmol2VL=4mol/L,故C正确;
D、加热蒸发HCl挥发,溶液浓度降低,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 实验指出,无水氯化铝在常压条件下存在的形式常为AlCl3和Al2Cl6两种分子。已知无水氯化铝在不同温度 时的密度数据如下表

可见,600℃时无水氯化铝存在形式的化学式为
[? ]
A.AlCl3
B.Al3Cl6
C.AlCl3和Al2Cl6
D.Al3Cl9
参考答案:C
本题解析:
本题难度:一般