微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)某课外活动小组同学用图一装置进行实验,试回答下列问题。
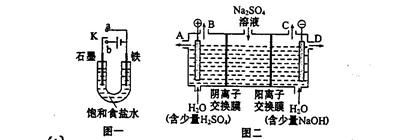
(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的?腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式?。
(2)芒硝(化学式为Na2SO4·10H2O),无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法。用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率来看都更加符合绿色化学理念。
① 该电解槽的阳极反应式为:?,此时通过阴离子交换膜的离子数?(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”)?导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为?。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有?kJ的能量转化为电能。
参考答案:(1)① 吸氧?② 2Cl— +2H2O 2OH— + H2↑+ Cl2↑
2OH— + H2↑+ Cl2↑
(2)① 4OH—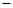 4e—=2H2O + O2↑?小于?② D?③ H2
4e—=2H2O + O2↑?小于?② D?③ H2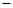 2e—+ 2OH—=2H2O? 571.6
2e—+ 2OH—=2H2O? 571.6
本题解析:(1)① 若开始时开关K与a连接,则构成原电池,由于溶液显中性,所以发生钢铁的吸氧腐蚀。
②若开始时开关K与b连接,则构成电解池,石墨和电源的正极相连,作阳极,溶液中的氯离子放电。铁和电源的负极相连,作阴极,溶液中的氢离子放电,所以方程式为2Cl— +2H2O 2OH— + H2↑+ Cl2↑。
2OH— + H2↑+ Cl2↑。
(2)①电解池中阳极失去电子,则溶液中的OH-失去电子,方程式为 4OH—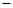 4e—=2H2O + O2↑。由于通过阴离子交换膜的是SO42-,而通过阳离子交换膜的是H+,所以根据电荷守恒可知,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。
4e—=2H2O + O2↑。由于通过阴离子交换膜的是SO42-,而通过阳离子交换膜的是H+,所以根据电荷守恒可知,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。
②氢氧化钠在阴极生成,所以从D处导出。
③原电池中负极失去电子,正极得到电子,所以氢气在负极通入。由于溶液是氢氧化钠溶液,因此负极电极反应式为H2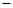 2e—+ 2OH—=2H2O。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以生成36g水放出的热量是285.8 kJ×2=571.6kJ,即有571.6kJ的能量转化为电能。
2e—+ 2OH—=2H2O。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以生成36g水放出的热量是285.8 kJ×2=571.6kJ,即有571.6kJ的能量转化为电能。
本题难度:一般
2、选择题 16.如图a、b、C.d均为石墨电极,通电进行电解。
下列说法正确的是
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,C电极附近变红
C.向乙中通人适量HCl气体溶液组成可以恢复
D.当b极有64gCu析出时,C电极产生2g气体
参考答案:AC
本题解析:本题考查电化学的知识,试验难度中等。a极与电源的正极相连,a为电解池的阳极,b为阴极,电解硫酸铜溶液,则OH-在阳极上放电,电极反应式为:4OH--4e-=O2↑+2H2O,A项正确;在乙中c为阳极,d为阴极,电解饱和氯化钠溶液,阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,加入酚酞,在阴极附近变红,B项错误;根据电极反应,2NaCl+2H2O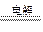 2NaOH+H2↑+Cl2↑,通人适量HCl气体溶液组成可以恢复,C项正确;根据电荷守恒,析出64gCu则转移电子为2mol,C电极生成气体1mol,质量为71g,D项错误。
2NaOH+H2↑+Cl2↑,通人适量HCl气体溶液组成可以恢复,C项正确;根据电荷守恒,析出64gCu则转移电子为2mol,C电极生成气体1mol,质量为71g,D项错误。
本题难度:一般
3、选择题 下列叙述不正确的是
A.铁表面镀铜,铜作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应: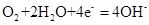
D.电解精炼铜时,阳极溶解的铜与阴极析出的铜质量相等
参考答案:D
本题解析:电镀时镀层金属作阳极,A正确。锌比铁活泼,所以B是牺牲阳极的阴极保护法,正确。吸氧腐蚀中,正极氧气得到电子,C正确。由于粗铜中含有杂质,所以电解精炼铜时,阳极溶解的铜与阴极析出的铜质量不相等,答案选D。
本题难度:一般
4、选择题 下列叙述不正确的是
A.电镀时,应把镀件置于电解槽的阴极,电镀液应含有镀层金属的阳离子
B.中国第1艘液化天然气船“大鹏昊”船底镶嵌锌块,锌作负极,可以防止船体被腐蚀
C.电解水的过程中,阴极区附近的溶液的pH会降低
D.将钢铁与电源的负极相连可以起到保护钢铁的作用
参考答案:C
本题解析:电解水过程中阳极,氢氧根放电生成氧气,阴极氢离子放电,生成氢气;氢离子和氢氧根均来源与水的电离。故阴极去,氢离子放电后,剩下氢氧根,pH增大。
本题难度:简单
5、选择题 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。

下列说法不正确的是
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
参考答案:B
本题解析:A、因铁的金属性比铜强,形成原电池铁作负极,铁铆钉被氧化而腐蚀,正确; B、若水膜中溶解了SO2,水膜的酸性增强,则铁铆钉腐蚀的速率变大,错误;C、铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O ,正确;D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀,正确。
本题难度:一般