微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作中,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸
B.硫酸铁溶液中滴加硫氰化钾溶液
C.铁丝置于氯化铜溶液中一段时间
D.氯化铁溶液中加入还原性铁粉
参考答案:A
本题解析:A.碳酸氢钠溶液中滴加稀盐酸,反应生成氯化钠、水和二氧化碳,溶液还是无色,颜色不发生变化,A正确。
B.硫酸铁溶液中滴加硫氰化钾溶液,溶液会出现血红色,颜色发生变化,B错误。
C.铁丝置于氯化铜溶液中一段时间,发生反应生成氯化亚铁和铜,溶液颜色由蓝色变为浅绿色,颜色发生变化,C错误。
D.氯化铁溶液中加入还原性铁粉,发生反应生成氯化亚铁,溶液由黄色变为浅绿色,颜色发生变化,D错误。
故选A
本题难度:一般
2、推断题 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________________。
(2)A的氢化物的分子空间构型是________,其中心原子采取__________杂化,属于__________(填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下
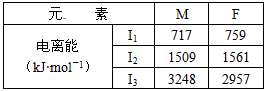
|
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是
______________________;
(4)晶体熔点:DC________EC(填“<、=、>”),原因是_______________________。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下

H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因__________________________
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式 (写一个)
__________________________
参考答案:(1)C<O<N
(2)正四面体;sp3杂化;非极性分子
(3)Mn2+的3d轨道电子排布为半满状态较稳定
(4)>;MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以熔点高
(5)H2O2分子间存在氢键,与水分子可形成氢键
(6)“略”
本题解析:
本题难度:困难
3、选择题 按要求写出下列变化,(1)(2)写化学方程式,(3)(4)写离子方程式
(1)实验室用Ca(OH)2和NH4Cl制取氨气:?
(2)氢氧化钠溶液与二氧化硅反应:?
(3)将Na2O2粉末投入水中:?
(4)向AlCl3溶液中加入足量氨水:?
参考答案:(1)Ca(OH)2 + 2NH4Cl  ?CaCl2 + 2NH3↑+ 2H2O
?CaCl2 + 2NH3↑+ 2H2O
(2)SiO2 + 2NaOH = Na2SiO3 + H2O
(3)2Na2O2 + 2H2O = 4Na+ + 4OH— + O2↑
(4)Al3++ 3NH3·H2O= Al(OH)3↓ + 3NH4+
本题解析:(1)实验室用Ca(OH)2和NH4Cl制取氨气,化学方程式为:
Ca(OH)2 + 2NH4Cl  ?CaCl2 + 2NH3↑+ 2H2O;
?CaCl2 + 2NH3↑+ 2H2O;
(2)氢氧化钠溶液与二氧化硅反应生成硅酸钠和水,化学方程式为:SiO2 + 2NaOH = Na2SiO3 + H2O;(3)将Na2O2粉末投入水中,二者反应生成氢氧化钠和氧气,离子方程式为:
2Na2O2 + 2H2O = 4Na+ + 4OH— + O2↑;
(4)向AlCl3溶液中加入足量氨水,二者反应生成氢氧化铝沉淀和氯化铵,离子方程式为:
Al3++ 3NH3·H2O= Al(OH)3↓ + 3NH4+。
本题难度:一般
4、填空题 (8分)甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:

(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液,写出下列转化的方程式:
乙 丙的离子方程式_____________________________;
丙的离子方程式_____________________________;
丙 甲的化学方程式______________________________。
甲的化学方程式______________________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。甲 乙的离子方程式是______________________________。
乙的离子方程式是______________________________。
参考答案:(8分)(每空2分)?(1)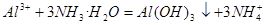
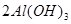

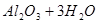 ?(2)
?(2)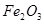 ?
?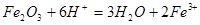
本题解析:(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液,这说明甲是两性氧化物,所以甲是氧化铝,则乙是硫酸铝,丙是氢氧化铝。氢氧化铝受热分解即生成氧化铝。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,这说明乙中含有铁离子,所以丙是氢氧化铁。氢氧化铁受热分解生成氧化铁,因此甲是氧化铁。
点评:该题是高考中的常见考点,属于中等难度的试题。试题注重基础知识的考查,兼顾能力的训练,有利于培养学生的逻辑思维能力。该题的关键是熟练记住常见物质的性质,包括物理性质和化学性质,然后灵活运用即可,该题不难得分。
本题难度:一般
5、选择题 下列说法中正确的是(?)
A.向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象
B.将8 g SO3放入92 g水中,所得溶液溶质质量分数为8 %
C.已知H+(aq)+ OH-?(aq) = H2O(l);△H =" -57.3" kJ/mol。将4 g氢氧化钠固体放入100 mL
1 mol/L的稀盐酸中,放出了5.73 kJ的热量
D.向100 ml 1 mol/L的Ca(HCO3)2溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱
参考答案:D
本题解析:略
本题难度:简单