| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《有关氧化还原反应的计算》试题特训(2017年最新版)(四)
参考答案:C 本题解析:A.100ml 4mol/L盐酸的物质的量是0.4mol,8.7gMnO2的物质的量是0.1mol,二者在反应过程中盐酸的浓度逐渐降低,而二氧化锰不能氧化稀盐酸,所以共热能制取氯气的分子数小于0.2NA,A错误;B.一定温度下0.1L 0.1mol/L的HA和1L0.01mol/L的HA所含A-微粒数不一定均为0.01NA,因为不能确定HA的强弱,B错误;C.CO2和N2O的相对分子质量相等,均是44,且均含有3个原子,所以在常温常压下,44g CO2与N2O的混合物中含有的原子总数为3 NA,C正确;D.1mol Cl2与足量的金属铝反应,转移电子数为2NA,D错误,答案选C。 本题难度:一般 3、选择题 在一定条件下, RO3n-和氟气发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是 ( ) |
参考答案:B
本题解析:根据离子反应方程式RO3n-+F2+2OH-=RO4-+2F-+H2O,利用电荷守恒确定n的值,再利用化合价计算的原则来求R元素的化合价即可。由离子方程式RO3n-+F2+2OH-=RO4-+2F-+H2O,反应后1个RO4-离子带1个单位的负电荷、2个F-离子带2个单位的负电荷,而反应前2个OH-离子带2个单位负电荷,根据反应前后的电荷守恒,可判断n=1,则离子RO3n-为RO3-;设RO3-离子中R元素的化合价为x,则有x+(-2)×3=-1,解得x=+5.选B。
考点:考查利用离子反应方程式来确定原子团中元素的化合价的方法。
本题难度:一般
4、选择题 下列化学用语正确的是(?)
A.表示乙炔“燃烧热”对应的热化学方程式:
C2H2(g)+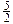 O2(g) = 2CO2(g)+H2O(g);?△H =-1 256 KJ/mol
O2(g) = 2CO2(g)+H2O(g);?△H =-1 256 KJ/mol
B.Na2O2的电子式:
C.卤化氢都极易溶于水,溶液均为强酸
D.表示中和热的热化学方程式:
NaOH(aq)+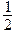 H2SO4(aq)=
H2SO4(aq)=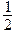 Na2SO4(aq)+H2O(l) ; △H = -57.3kJ/mol
Na2SO4(aq)+H2O(l) ; △H = -57.3kJ/mol
参考答案:D
本题解析:略
本题难度:一般
5、填空题 用双桥法分析下列反应,并指出氧化剂和还原剂。
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)2H2?+ ?O2 ==2H2O
参考答案:(每个方程式4分,共8分)给分点:双桥连接1分,得失电子数各1分,氧化剂、还原剂各1分
(1) ?(2)
?(2)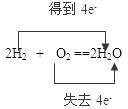
氧化剂:KMnO4?还原剂:HCl?氧化剂:O2?还原剂:H2
本题解析:在氧化还原反应中,氧化剂得到电子,化合价降低;还原剂失去电子,化合价升高。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学试题《碳族元素》考点预.. | ||