微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列过程中,涉及化学变化的是
[? ]
A.氯气通入水中制氯水
B.四氯化碳萃取碘水中的碘
C.活性炭使红墨水褪色
D.蒸馏法将海水淡化为饮用水
参考答案:A
本题解析:
本题难度:简单
2、实验题 某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
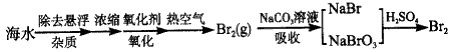
(1)取24 L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:___________ ,通入热空气的目的:____________;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、 NaBrO3和CO2,反应的化学方程式:_____________,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:_______________,理论上可以得到Br2的质量为_____________;
(5)请计算海水中溴的浓度为____________g/L。
参考答案:(2)Cl2+2Br-=Br2+2Cl-? ;将 Br2吹出
(3)3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(4)5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O? ;1.6 g
(5)0.07
本题解析:
本题难度:一般
3、简答题 镁是一种性质活泼、用途广泛的金属,研究镁的冶炼性质对于生产、生活意义重大.
(一)目前世界上60%的镁是从海水中提取的.已知从海水中提炼镁的主要步骤如图:
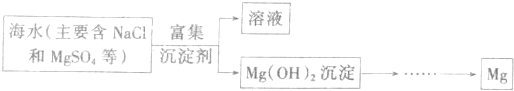
学生结合这个课题提出了以下问题:
(1)从海水中提取镁的过程中如何实现对镁的富集?
学生1的观点:直接往海水中加入沉淀剂.
学生2的观点:高温加热蒸发海水后,再加入沉淀剂.
学生3的观点:利用上述海水晒盐后剩余的溶液,加入沉淀剂.
请你评价三个学生提出的观点是否合理(填“是”或“否”),若不合理请简述理由.
| 观点 | 是否正确 | 简述理由
学生1
否
______
学生2
______
______
学生3
______
______
|
(2)从海水中提镁的过程中如何实现对镁的分离?
①过程中所用沉淀剂的制造原料也来源于海洋,则该沉淀剂是______(填化学式).
②试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼镁的方法是______(填选项字母).
A.Mg(OH)2MgOMg
B.Mg(OH)2MgOMg
C.Mg(OH)2无水MgCl2Mg
D.Mg(OH)2MgCl2溶液Mg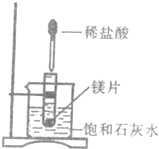
(二)为了研究镁的性质,先用工业制得的纯净的镁做如图所示实验.把试管放入盛有25℃饱和石灰水的烧杯中,然后在试管中放入镁片,再用滴管滴入一定量盐酸.请回答:
(1)实验中观察到的现象有
①______;②______;③______;
(2)烧杯中产生对应现象的原因为______.
参考答案:(一)(1)学生1:还是中氯化镁浓度很小,向溶液中加入石灰乳时,二者几乎不产生Mg(OH)2沉淀,所以该观点不合理;
学生2:高温蒸发海水后使NaCl过饱和而析出,从而使Mg(OH)2沉淀中混有较多NaCl杂质,导致不纯,所以该该浓度不合理;
学生3:利用晒盐后的苦卤,节约能源,成本低;与学生1相比镁离子浓度高,有利于镁元素的富集,所以该观点正确,
故答案为:
海水中氯化镁浓度太小,直接加沉淀剂几乎不产生Mg(OH)2沉淀否高温蒸发海水后会使NaCl过饱和而析出,从而使Mg(OH)2沉淀中混有较多NaCl杂质是镁离子富集浓度高,成本低(2)①硫酸镁转化为Mg(OH)2应该向溶液中加入碱,原料来源于海洋,贝壳中含有碳酸钙,将贝壳煅烧得到CaO,将CaO溶于水得到Ca(OH)2,用Ca(OH)2作沉淀剂,故答案为:Ca(OH)2;
②A.MgO熔点很高,电解熔融MgO制取Mg,会导致成本较高,不利于节约能源,故A错误;
B.MgO熔点很高,电解熔融MgO制取Mg,会导致成本较高,不利于节约能源,且电解熔融MgO条件不易控制,故B错误;
C.电解熔融氯化镁制取镁符合节约能源,且能制取较纯净的镁,故C正确;
D.氯化镁溶液和活泼金属不能发生置换反应生成Mg,故D错误;
故选C;
(二)(1)在金属活动性顺序表中,Mg位于氢之前,Mg和稀HCl反应生成可溶性的MgCl2和氢气,且放出大量热,温度越高,Ca(OH)2的溶解度越小,所以Mg和稀HCl反应的过程中放出的热量导致有Ca(OH)2析出,所以看到的现象是:试管中有气泡产生、镁片逐渐溶解、烧杯中溶液变浑浊,
故答案为:①试管中有气泡产生;②镁片逐渐溶解;③烧杯中溶液变浑浊;
(2)温度越高,Ca(OH)2的溶解度越小,所以Mg和稀HCl反应的过程中放出的热量导致有Ca(OH)2析出,故答案为:镁片与盐酸反应并放热,Ca(OH)2的溶解度随温度升高而降低.
本题解析:
本题难度:一般
4、填空题 海水中溶解了大量的气体物质和各种盐类。人类在陆地上发现的100多种元素中,有80多种可以在海水中找到。海洋是一个远未被完全开发的、巨大的化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,其技术和工艺比较完备,但大量使用燃煤,能耗多、排污量大。为克服 蒸馏法淡化海水的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议:____。
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式:____。
(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
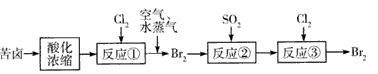
a.反应②的离子方程式为____,
b.从反应③后的四氯化碳溶液中分离出单质溴的方法是____。
(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4。如何测定苦卤中MgCl2的含量:___ (用简要的文字说明)。
参考答案:(1)充分利用潮汐能、风能、太阳能等海边富有的洁净能源
(2) CH2 ==CHCOONa
(3)SO2+Br2+2H2O==4H++2Br-+SO42- ;蒸馏
(4)先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+的量,减去MgSO4中的Mg2+的量得到MgCl2的量
本题解析:
本题难度:一般
5、选择题 海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示)下列有关说法不正确的是

[? ]
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
参考答案:D
本题解析:
本题难度:一般