微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
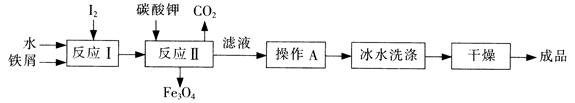
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
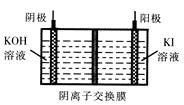
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
参考答案:(1)① Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑ (2分)
②加热浓缩、冷却结晶、过滤 (2分)
洗涤除去表面可溶性杂质,同时减少KI的溶解损失 (2分)
(2)①在较高温度下KIO3易分解(2分) ②1700 (2分)
③I一+ 3H2O通电IO3- + 3H2↑ (2分) 不变(2分)
本题解析:(1)①反应I生成铁与碘的化合物,铁元素与碘元素的质量比为21:127,即物质的量比是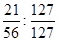 =3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
=3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
②用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)①烹饪时,含KIO3的食盐常在出锅前加入,其原因是在较高温度下KIO3易分解;
②因为H2O2氧化I2先制得HIO3:5H2O2+I2==2HIO3+4H2O,即5H2O2~2IO3-,1284 kg KIO3固体为6k mol,故m(H2O2)= 5/2×6kmol×34g·mol-1/30%=1700kg。
③虽然阴极区有大量氢氧根离子生成,但阳极区反应消耗氢氧根离子,氢氧根离子通过阴离子交换膜到阳极区反应,总反应中没有酸或碱生成以及消耗。故而阴极区反应前后pH没有变化。当然,如果题目没有“忽略溶液体积变化“的说明,情况就不同了,随着电解的进行,总反应耗水,阴极区pH会增大。
考点:官能团为酯键的芳香化合物的性质。
本题难度:一般
2、选择题 用铂电极电解CuSO4和KNO3的混合溶液500 mL,经过一段时间后,两极均 得到标准状况下11.2 L的气体,则原混合溶液中CuSO4的物质的量浓度为(? )
A.0.5 mol?L-1
B.0.8 mol?L-1
C.1.0 mol?L-1
D.1.5 mol?L-1
参考答案:C
本题解析:阳极发生电极反应:4OH--4e-=2H2O+O2↑,失去电子的物质的量=n(O2)×4="(11.2/22.4)×4" mol="2" mol;阴极发生电极反应:首先发生的是Cu2++2e-=Cu,其次是2H++2e-=H2↑,阴极得到电子的物质的量=n(Cu2+)×2+n(H2)×2=n(Cu2+)×2+(11.2/22.4)×2mol,两电极物质得失电子数相等,即2 mol=n(Cu2+)×2+(11.2/22.4)×2 mol。解得n(Cu2+)="0.5" mol,n(CuSO4)=n(Cu2+)="0.5" mol,其物质的量浓度="0.5" mol/(500×10-3L)="1.0" mol·L-1,答案为C。
本题难度:一般
3、填空题 如图所示,若电解5min时,C中铜电极质量增加4.32g,试回答
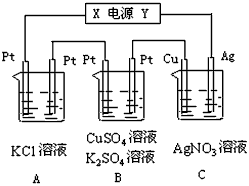
(1)电源电极X名称为________。
(2)各池pH值的变化A________ B_________、C__________。(填“增大”、“减小”或“不变” )
(3)通电5min后,B池中共收集到448mL气体(标况),溶液体积为200mL(假设反应前后溶液体积不变化),则通电前硫酸铜溶液的物质的量浓度为______________。
(4)常温下若A池中KCl溶液的体积仍是40mL,电解生成的气体全部排出, 电解后溶液的pH 值是_________。如果想使反应溶液恢复到原来状态,应该向B池中加入________,其质量为_________。
参考答案:(1)负极
(2)增大;减小;不变
(3)0.05mol/L
(4)14;Cu(OH)2(或CuO、H2O);0.98g(0.8g、0.18g)
本题解析:
本题难度:一般
4、选择题 Cu2O是一种半导体材料,用作制造整流器的材料,还可以用于制船底防污漆(杀死低级海生动物)、农作物的杀菌剂。在实验室里可模拟工业过程制取Cu2O,总反应式是2Cu+H2O Cu2O+H2↑,其装置如图,下列有关说法不正确的是
Cu2O+H2↑,其装置如图,下列有关说法不正确的是
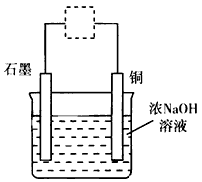
[? ]
A.该实验符合绿色化学的设计理念
B.图中的虚线框内需连接直流电源,且正极与石墨相连
C.CuO高温加热分解也可以得到Cu2O
D.上述装置中,阳极的电极反应式是2Cu+2OH-→Cu2O+H2O+2e-
参考答案:B
本题解析:
本题难度:一般
5、选择题 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH) 2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:D
本题解析:Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,由电解的总反应式为:
2H2O+2CuSO4 2Cu+O2↑+2H2SO4 ?转移电子
2Cu+O2↑+2H2SO4 ?转移电子
2mol ?4mol
0.1mol ?0.2mol
2H2O 2H2↑+O2↑?转移电子
2H2↑+O2↑?转移电子
2mol?4mol
0.1mol ?0.2mol
所以电解过程中共转移电子为0.4 mol.
故选D。
点评:本题考查电解池的工作原理,电解池中有关电子转移数的计算技巧与能力,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量。难度稍难。
本题难度:一般