微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:
m A(s)+n B(g)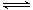 p C(g)+q D(g)? △H达到平衡后,测得B的浓度为0.5 mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.3mol·L-1。当其它条件不变时,C在反应混合物中的体积分数(
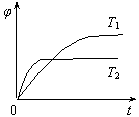
p C(g)+q D(g)? △H达到平衡后,测得B的浓度为0.5 mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.3mol·L-1。当其它条件不变时,C在反应混合物中的体积分数(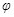 )与温度(T)、时间(t)的关系如图所示。下列叙述正确的是
)与温度(T)、时间(t)的关系如图所示。下列叙述正确的是
A.热化学方程式中:n<p+q
B.热化学方程式中:△H>0
C.达平衡后,增加A的量,有利于提高B的转化率
D.若T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
参考答案:D
本题解析:密闭容器的容积扩大到原来的两倍的瞬间,B的浓度应是0.25mol/L,但最终平衡时B的浓度为0.3mol·L-1,这说明降低压强,平衡向逆反应方向进行,即正反应是体积减小的反应,所以n>p+q,A不正确。根据图像可知,温度为T2的曲线首先达到平衡状态,即T2大于T1。温度越高,C的体积分数越小,石墨升高温度平衡向逆反应方向进行,即正反应是放热反应,B不正确。A是固体,不影响平衡状态,C不正确。升高温度平衡向逆反应方向进行,所以平衡常数减小,D正确,答案选D。
本题难度:简单
2、选择题 下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.水汽化需要吸收能量,所以水汽化属于吸热反应
C.可燃物的燃烧都是放热反应
D.反应是吸热还是放热,必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小
参考答案:A、化学反应的特征是:一是生成新物质,二是伴随着能量的变化,故A正确;
B、吸热反应属于化学反应,水汽化属于物质状态之间的转化是物理变化,所以水汽化不属于吸热反应,故B错误;
C、任何发光发热的剧烈的氧化还原反应都是燃烧反应,所以燃烧反应都是放热反应,故C正确;
D、旧键断裂时吸收的能量大于新键形成时释放的能量,为吸热反应,旧键断裂时吸收的能量小于新键形成时释放的能量,为放热反应,所以反应是吸热还是放热,必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小,故D正确;
故选B.
本题解析:
本题难度:简单
3、选择题 下列关于盖斯定律的说法不正确的是
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
参考答案:D
本题解析:略
本题难度:简单
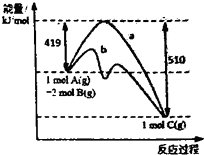
4、选择题 反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=-510kJ.mo1-1