微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于下列各实验装置的叙述中,不正确的是
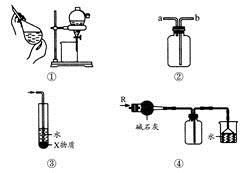
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
参考答案:A
本题解析:装置①可用于分离互不相溶的混合物,而C2H5OH和H2O互溶,A错;装置②a口进气可收集H2、NH3等气体,b口进气可收集CO2、Cl2、HCl、NO2等气体,B正确;NH3或HCl不溶于CCl4,可防止倒吸,C错;碱石灰可吸水且不与氨反应,倒扣漏斗可防倒吸,D正确。
本题难度:一般
2、选择题 除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及其顺序正确的是
A.AgNO3、Na2CO3、HNO3
B.AgNO3、Na2CO3、HCl
C.Na2CO3、AgNO3、HNO3
D.AgNO3、K2CO3、HNO3
参考答案:A
本题解析:根据除杂的原则,选择适当的试剂,NaCl用硝酸银溶液、Ca(NO3)2用Na2CO3溶液;再根据除杂的试剂是过量的,确定试剂的顺序以及所需试剂,为了把过量的硝酸银溶液除去,可用Na2CO3溶液来除,最后过量的Na2CO3溶液可用硝酸来除,而过量的硝酸可加热挥发。首先加入过量的硝酸银,将氯离子全部沉淀,因此溶液中就有了过量的Ag+离子,然后向溶液中加入过量的Na2CO3,Ca+和Ag+都形成沉淀,这样溶液中就有了过量的CO32-,向溶液中加入过量的硝酸,将CO3?2-变成CO2除去,溶液中含有了过量的HNO3,因为硝酸易挥发,加热可以将硝酸除去,最后得到纯净的NaNO3.故选A。
本题难度:一般
3、实验题 (12分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
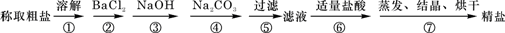
(1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。
(2)步骤2中,判断加入BaCl2已过量的方法是:?
(3)除杂试剂BaCl2、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答)? ?。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
(5)为检验精盐纯度,需配制200 mL 1 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是:?
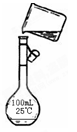
(6)配制过程中,下列操作情况会使结果偏低的是
A.称量时,托盘天平左盘加砝码,右盘加氯化钠
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容
参考答案:(12分,第一题一空1分,其余每空2分)
(1)玻璃棒漏斗?
(2)在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(其它合理答案也可)? 2分
(3)NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH? 2分
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度? 2分
(5)未用玻璃棒引流;未用200mL容量瓶。2分
(6)AD?各1分,共2分多选、错选不得分。
本题解析:(1)步骤⑤是过滤,需要的玻璃仪器是烧杯、玻璃棒和漏斗。
(2)判断加入BaCl2已过量的方法是继续加入氯化钡溶液,即在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(3)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+和铁离子用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,即NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH。
(4)若先用盐酸调pH值再过滤,则在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度。
(5)根据示意图可知,存在的错误是未用玻璃棒引流和未用200mL容量瓶。
(6)根据c=n/V可知,称量时,托盘天平左盘加砝码,右盘加氯化钠,则溶质的质量减少,浓度偏小;移液前,容量瓶中有少量蒸馏水未倒出,不影响实验结果;定容时,俯视容量瓶刻度线观察液面,则容量瓶中溶液的体积减少,浓度偏高;定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,则容量瓶中溶液的体积增加,浓度偏小,所以答案选AD。
本题难度:一般
4、实验题 为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:
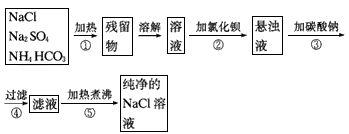
(1)操作②能否用硝酸钡溶液?____。理由是____。
(2)进行操作②后,如何判断SO42-已除尽,方法是____。
(3)操作③的目的是_____;为什么不先过滤而后加碳酸钠溶液,其理由是____。
(4)此设计方案是否严密,如不严密,说明如何改进_____________。
参考答案:(1)不能 ;会引入新的杂质(NO3-)
(2)取少量上层澄清溶液,滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有
(3)除去过量的Ba2+一次性过滤,简化实验步骤
(4)不够严密。a.在②、③处加过量溶液;b.在⑤处应先加过量的盐酸(除去过量的CO32-)后再加热。
本题解析:
本题难度:一般
5、选择题 现有Na2CO3、Ba(OH)2、H2SO4三种无色溶液,以下试剂一次可以鉴别的是
A.盐酸
B.碳酸铵
C.硫酸钠
D.氯化铵
参考答案:B
本题解析:
正确答案:B
(NH4)2CO3+Na2CO3无明显现象
(NH4)2CO3+Ba(OH)2=BaCO3↓+2NH3↑+2H2O有白色沉淀,刺激性气味气体
(NH4)2CO3+H2SO4=(NH4)2SO4+H2O+CO2↑有无色无味的气体。
本题难度:简单