微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.其它条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大
B.判断过程的自发性能确定过程能否发生和过程发生的速率
C.体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律
D.催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡
参考答案:A.其它条件相同时,增大浓度,活化分子数目增多,百分数没有变化,反应速率加快,故A错误;
B.过程的自发性与反应速率无关,可确定过程能否发生,故B错误;
C.由普遍规律可知,熵增的反应可自发进行,所以体系有自发地向混乱度增加(即熵增)的方向转变的倾向,故C正确;
D.催化剂降低反应所需的活化能,只影响反应速率,不影响化学平衡,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 对于CaCO3溶于盐酸生成二氧化碳的反应,下列说法正确的是
[? ]
A. 该反应的离子方程式为CO32-+2H+=H2O+CO2↑
B. 盐酸的浓度不变用量增加一倍,生成二氧化碳的速率一定增大
C. 碳酸钙溶于盐酸是因为H+与CO32-反应,破坏了CaCO3的沉淀溶解平衡
D. CaCO3与适量的盐酸恰好完全反应所得的溶液中存在下列关系:
2c(Ca2+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
参考答案:C
本题解析:
本题难度:一般
3、选择题 据报道,美国俄亥冈大学的化学家已经找到名为trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨.该催化剂的作用是( )
A.使反应有新的进行途径
B.使反应放出更多的热量
C.使反应更完全
D.使反应物的化学键不需破坏
参考答案:A、催化剂的特点:能通过降低反应的活化能来改变化学反应速率,则使反应有新的进行途径,故A正确;
B、催化剂不会改变化学反应的反应热,故B错误;
C、催化剂不会引起化学平衡的移动,不会改变化学反应限度,故C错误;
D、化学反应的实质是旧键的断裂和新键的生成,加不加催化剂,化学反应中反应物的化学键均要破坏,故D错误.
故选A.
本题解析:
本题难度:简单
4、实验题 某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取
150mLO2所需的时间(秒)
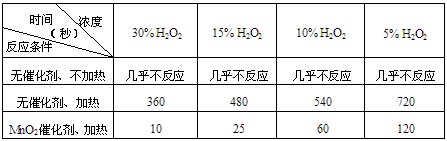
①该研究小组在设计方案时。考虑了浓度、_________、_________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响_____________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下

①写出H2O2发生的化学反应方程式_______________________。
②实验结果说明催化剂作用的大小与_____________有关。
参考答案:(1)①温度;催化剂
②升高温度化学反应速率增大或加催化剂化学反应速率增大
(2)① 2H2O2 2H2O+O2↑;②催化剂的聚集状态或表面积
2H2O+O2↑;②催化剂的聚集状态或表面积
本题解析:
本题难度:一般
5、选择题 对反应A+B AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
参考答案:A
本题解析:浓度越大,反应速率越快,①A、B的浓度各为0.5 mol·L-1;②A、B的浓度各为1 mol·L-1;③A、B的浓度各为0.05 mol·L-1;④A、B的浓度各为0.25 mol·L-1;所以四者反应速率的大小关系是②>①>④>③。
考点:本题考查化学反应速率。
本题难度:一般