微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验试用固体烧碱配制500mL?0.10mol?L-1的NaOH溶液.
(1)需称量______g烧碱固体,固体应该放在______中称量.
(2)配制过程中,一定不需要使用的仪器是(填写代号)______.
A.烧杯?B.量筒?C.玻璃棒?D.1000mL容量瓶
E.锥形瓶?F.胶头滴管?G.500mL容量瓶
(3)根据实验试的实际需要和(2)中列出的仪器判断,完成实验还缺少的仪器是______.
(4)某学生实际配制得到NaOH溶液的浓度为0.090mol?L-1,原因可能是______.
A.使用滤纸称量氢氧化钠固体?B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤?D.胶头滴管加水定容时仰视刻度.
参考答案:(1)m=CVM=0.10mol/L×0.5L×40g/mol=2.0g,烧碱具有腐蚀性,所以放在烧杯中称量,故答案为:2.0;烧杯;
(2)用烧杯溶解药品、用玻璃棒搅拌和引流、用胶头滴管定容、用500mL容量瓶配制溶液、可以用量筒加水,所以一定不需要的仪器是:1000mL容量瓶、锥形瓶,故选DE;
(3)还缺少的仪器有:称量药品的托盘天平、取药品的药匙,故答案为:托盘天平、药匙;
(4)某学生实际配制得到NaOH溶液的浓度为0.090mol?L-1,配制溶液浓度偏低,
A.使用滤纸称量氢氧化钠固体,溶质的物质的量偏小,配制溶液浓度偏低;?
B.容量瓶中原来存有少量蒸馏水,溶质的物质的量和溶液的体积都不变,配制溶液浓度不变;
C.溶解后的烧杯未经多次洗涤,溶质的物质的量偏小,配制溶液浓度偏低;?
D.胶头滴管加水定容时仰视刻度,溶液体积偏大,配制溶液浓度偏低;
故选ACD.
本题解析:
本题难度:一般
2、选择题 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32—、SO42—,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
①K+一定存在
②100 mL溶液中含0.01 mol CO32—
③Cl-可能存在
④Ba2+一定不存在
⑤Mg2+可能存在
A.③④⑤
B.①③④
C.①②
D.③④
参考答案:B
本题解析:由(2)知含有NH4+ 0.04 mol,由(3)知含有CO32— 0.02 mol,含有SO42— 0.01 mol,所以不含有Mg2+和Ba2+,根据溶液呈电中性K+至少含有0.02 mol,而Cl-是否存在无法判断。
点拨:本题考查离子的检验,考查考生对离子检验的判断能力。难度中等。
本题难度:一般
3、简答题 将一定质量的Mg-A1合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如右图.计算下列问题:(写出简要计算过程)?
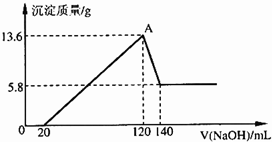
(1)求合金中Mg与Al的物质的量之比?
(2)所加NaOH溶液的物质的量浓度是多少?
(3)原HCl溶液的物质的量浓度是多少?
参考答案:(1)由图象可知溶于NaOH溶液的沉淀为13.6g-5.8g=7.8g,该沉淀为Al(OH)3,
物质的量为n(Al(OH)3)=7.8g78g/mol=0.1mol,即0.1molAl(OH)3,
不溶于NaOH溶液的Mg(OH)2沉淀为5.8g,物质的量为n(Mg(OH)2)=5.8g58g/mol=0.1mol,
原合金中n(Al)=n(Mg)=0.1mol,故物质的量之比是1:1.
答:合金中Mg与Al的物质的量之比为1:1.
(2)由Al(OH)3与NaOH反应的方程式计算,
?Al(OH)3+OH-═AlO2-+H2O
1mol? 1mol
0.1mol? c(NaOH)×(140-120)×10-3
得c(NaOH)=5mol?L-1
答:所加NaOH溶液的物质的量浓度是5mol?L-1.
(3)图象中A点为沉淀量最大时,此时溶液溶质为NaCl,故n(Na+)=n(Cl-)=0.12L×5mol?L-1=0.6mol,
c(HCl)=0.6mol0.1L=6mol?L-1
答:原HCl溶液的物质的量浓度是6mol?L-1.
本题解析:
本题难度:一般
4、选择题 有一未知浓度的硫酸溶液25 mL,在加入0.5 mol·L-1 Ba(NO3)2溶液25 mL后,改加NaOH溶液,结果用去1.0 mol·L-1 NaOH溶液50 mL恰好完全中和,则硫酸的物质的量浓度是(?)
A.0.5 mol·L-1
B.1.0 mol·L-1
C.1.5 mol·L-1
D.2.0 mol·L-1
参考答案:B
本题解析:因为H2SO4+Ba(NO3)2====BaSO4↓+2HNO3,H+并没参加反应,而是加入NaOH溶液时,H+才被中和,故根据:
 ====2Na2SO4+2H2O,n(H2SO4)=
====2Na2SO4+2H2O,n(H2SO4)= =2.5×10-2 mol,故c(H2SO4)=
=2.5×10-2 mol,故c(H2SO4)= ="1" mol·L-1。
="1" mol·L-1。
本题难度:简单
5、计算题 在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
实验序号
| 甲
| 乙
| 丙
|
合金质量
| 0.390g
| 0.702g
| 0.936g
|
气体体积
| 448mL
| 672mL
| 672mL
|
分析上表数据后计算:
(1)盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0. 2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
参考答案:(1)由题意知,当合金的质量分别是0.702g与0.936g时,发出的气体均为672ml,说明合金均已过量,盐酸已完全反应完,从测出的氢气体积,就可以计算盐酸的物质的量浓度,
0.672÷22.4×2÷0.1=0.6(mol/l)? (2分)
(2)合金质量为0.39g时,气体只有448ml,说明此时盐酸是过量的。设合金中含镁为xmol 含铝为ymol,根据反应的化学方程式:Mg+2HCl===MgCl2 + H2↑? 2Al+6HCl===2AlCl3 +3H2↑
则有:? 24x + 27y="0.390?" x +3y/2 =0.448÷22.4
解联立方程组得:? x="0.005?" y="0.01?" 所以镁铝的物质的量之比是1:2
(比值2分)
(3) 若要使生成的沉淀最少,说明只得到Mg(OH)2沉淀,而此时铝元素以AlO2-的形式存在,根据电荷守恒,可列式如下:n(Na+)×1=n(Cl-)×1+n(AlO2-)×1
得n(Na+)=0.06×1+0.01×1=0.07(mol)
所加的NaOH溶液体积为:0.07/0.2="0.35(L)=350mL?" (2分)
本小题用其它合理方法解答出正确结果的,也同样给分。
本题解析:略
本题难度:简单