| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《离子方程式的书写及正误判断》考点特训(2017年冲刺版)(四)
参考答案:D 本题解析:A.铜溶于稀硝酸中的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,A错误;B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O,B错误;C.向NaAlO2溶液中通入过量的CO2的离子方程式为AlO2—+CO2+2H2O=Al(OH)3↓+HCO3-,C错误;D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH- 本题难度:一般 2、选择题 下列解释事实的离子方程式不正确的是 |
参考答案:C
本题解析:A.消毒液的次氯酸钠与洁厕灵主要成份盐酸混合发生归中反应产生氯气,方程式为:Cl-+ClO-+2H+=Cl2↑+H2O,A正确;B.向水玻璃即硅酸钠溶液中加入盐酸有白色沉淀生成:2H++SiO32-=H2SiO3↓,B正确;C.SO2使紫色石蕊溶液变红色是由于SO2溶于水生成弱酸亚硫酸:SO2+H2O H2SO3,C错误;D.漂白粉溶液中次氯酸水解溶液显碱性,加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HClO,D正确,答案选C。
H2SO3,C错误;D.漂白粉溶液中次氯酸水解溶液显碱性,加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HClO,D正确,答案选C。
考点:考查离子方程式的正误判断
本题难度:一般
3、填空题 (共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的原子结构示意图为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,用离子方程式解释原因: 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
参考答案:(1)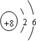 (2分); (2)N2H4的电子式
(2分); (2)N2H4的电子式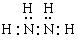 (2分)
(2分)
(3)NH4+ + H2O  NH3·H2O + H+(2分)
NH3·H2O + H+(2分)
(4)NH4++HSO3-+2OH- NH3+H2O+SO32-(2分)
NH3+H2O+SO32-(2分)
(5)HN3(2分); 2.24L(2分)
本题解析:由于X是原子半径最小的元素,所以X是H元素,加入Z的原子序数是m,则Y是(m-1);W是(m+8)。1+(m-1)+m+(m+8)=32。解得m=8。所以Y是N,Z是O;W是S。(1)Z原子的原子结构示意图为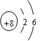 ,(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲是N2H4。则甲的电子式是:
,(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲是N2H4。则甲的电子式是: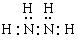 ;(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,该盐是(NH4)2SO4,该盐是强酸弱碱盐,NH4+发生水解反应消耗水电离产生的OH-,破坏了水的电离平衡,促进水的电离,最终当达到平衡时c(H+)>c(OH-),使溶液显酸性,用离子方程式表示为:NH4+ + H2O
;(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,该盐是(NH4)2SO4,该盐是强酸弱碱盐,NH4+发生水解反应消耗水电离产生的OH-,破坏了水的电离平衡,促进水的电离,最终当达到平衡时c(H+)>c(OH-),使溶液显酸性,用离子方程式表示为:NH4+ + H2O  NH3·H2O + H+;(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。该盐是酸式盐,有还原性,应该是NH4HSO3.加热条件下乙与过量NaOH溶液反应的离子方程式是NH4++HSO3-+2OH-
NH3·H2O + H+;(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。该盐是酸式盐,有还原性,应该是NH4HSO3.加热条件下乙与过量NaOH溶液反应的离子方程式是NH4++HSO3-+2OH- NH3+H2O+SO32-。(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,则每个分子中含有N:(43×97.7%)÷14=3,含有H:43—3×14=1,所以该氢化物的分子式为HN3;该氢化物受撞击时完全分解为氮气和氢气,2HN3
NH3+H2O+SO32-。(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,则每个分子中含有N:(43×97.7%)÷14=3,含有H:43—3×14=1,所以该氢化物的分子式为HN3;该氢化物受撞击时完全分解为氮气和氢气,2HN3  H2↑+3N2↑.n(HN3)=2.15g÷43g/mol=0.05mol,所以根据方程式可知该氢化物受撞击后产生的气体在标况下的体积为(0.05mol÷2) ×4×22.4mol/L=2.24L。
H2↑+3N2↑.n(HN3)=2.15g÷43g/mol=0.05mol,所以根据方程式可知该氢化物受撞击后产生的气体在标况下的体积为(0.05mol÷2) ×4×22.4mol/L=2.24L。
考点:考查元素及化合物的推断、原子结构示意图的书写、物质的电子式、化学式的确定、盐的水解、离子方程式的书写及有关氧化还原反应的计算的知识。
本题难度:困难
4、选择题 下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.NH4HSO3溶液与足量浓NaOH溶液共热:NH4++HSO3-+2OH-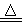 NH3↑+SO32-+H2O
NH3↑+SO32-+H2O
C.明矾溶于水产生Al(OH)3胶体: Al3++3H2O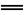 Al(OH)3↓+3H+
Al(OH)3↓+3H+
D.FeCl3溶液与Cu反应:Fe3++Cu = Fe2++ Cu2+
参考答案:B
本题解析:A、偏铝酸钠溶液中加入过量的稀盐酸,则产生的氢氧化铝沉淀优惠转化为铝离子,错误;B、亚硫酸氢铵与过量的氢氧化钠加热反应生成氨气、亚硫酸根卤族、水,正确;C、明矾溶于水产生氢氧化铝胶体,不能划沉淀符号,错误;D、不满足电荷守恒,错误,答案选B。
考点:考查离子方程式书写正误的判断
本题难度:一般
5、填空题 (10分)填写下列空白:
(1)NaHSO4在熔融状态下的的电离方程式为: ;
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为 ;
(3)向NaHCO3溶液中加过量的Ba(OH)2溶液 ,其离子方程式为 ___ ___ __
(4)向Ba(OH) 2溶液中通入过量的CO2,其离子方程式为 __________ _____
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式)______________________________________。
参考答案:(1) NaHSO4 = Na+ + HSO4- (2分)
(2) Ba2+ + SO42- + 2OH-- +2H+ = Ba SO4↓ + 2H2O。(2分)
(3) HCO3-- + Ba2+ + OH-- = H2O+BaCO3 ↓ (2分)
(4)OH- + CO2=HCO3- (2分)
(5)5SO2 +2MnO4- + 2H2O =2Mn2+ + 5SO42- + 4H+ (2分)
本题解析:(1)熔融状态下,共价键不被破坏,NaHSO4在熔融状态下的的电离方程式为:NaHSO4 = Na+ + HSO4-;(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,生成硫酸钡、硫酸钠和水,其离子方程式为Ba2+ + SO42- + 2OH-- +2H+ = Ba SO4↓ + 2H2O;(3)向NaHCO3溶液中加过量的Ba(OH)2溶液生成碳酸钡、氢氧化钠和水 ,其离子方程式为HCO3-- + Ba2+ + OH-- = H2O+BaCO3 ↓ ;(4)向Ba(OH) 2溶液中通入过量的CO2,生成碳酸氢钡,其离子方程式为OH- + CO2=HCO3-;(5)向酸性高锰酸钾溶液中通入二氧化硫气体,生成硫酸锰、硫酸钾、和硫酸,离子方程式为5SO2 +2MnO4- + 2H2O =2Mn2+ + 5SO42- + 4H+。
考点:考查离子方程式的书写。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《氯及其化合.. | ||