|
|
|
高考化学必考知识点《离子方程式的书写及正误判断》考点特训(2017年冲刺版)(五)
2017-03-05 13:21:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可以用离子方程式H++OH-=H2O表示的化学反应是
①稀硫酸与氢氧化钡溶液反应?②氢氧化钾溶液与稀硝酸反应
③稀盐酸与氢氧化铜反应?④澄清石灰水与盐酸反应
A.①③
B.②④
C.①②④
D.②③④
2、选择题 下列表示对应化学反应的离子方程式正确的是
A.SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO42-+Fe2++4H+
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+
C.NO2通入水中:3NO2+H2O===2H++2NO3—+NO
D.过量的CO2通入NaAlO2溶液中:2AlO2—+CO2+3H2O===2Al(OH)3↓+CO32-
|
3、实验题 (21分)实验室欲配制80mL,1.5 mol/L的NaHCO3溶液,试回答:
(1)该实验必须使用的玻璃仪有 ;
(2)配置该溶液时应称取NaHCO3的质量为_____________________;(3)下列操作对上述所配溶液物质的量浓度的影响(填写无影响、偏高或偏低)
A.配制过程中未洗涤烧杯和玻璃棒;
B.容量瓶使用之前未烘干,有少量蒸馏水;
C.定容时俯视容量瓶的刻度线;
D.将所配溶液从容量瓶转移到试剂瓶时,有少量液体溅出;__________
写出下列反应的离子方程式:
A.向NaHCO3溶液中滴加盐酸
B.向Ba(OH)2溶液中滴加少量NaHCO3溶液
C.向氨水中滴加MgCl2溶液
4、填空题 硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol?L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
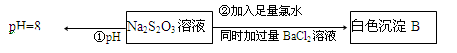
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH—
|
写出实验②发生反应的离子方程式
。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂
(填“是”或“否”),KMnO4溶液置于
(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会
(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为
。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
5、填空题 (16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
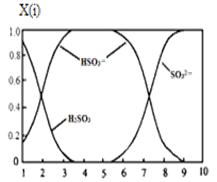
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)




