微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器里,A与B反应生成C,其反应速率分别用 表示,已知
表示,已知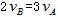 、
、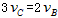 ,则此反应可表示为
,则此反应可表示为
[? ]
A.2A+3B = 2C
B.A+3B = 2C
C.3A+B = 2C
D.A+ B = C
参考答案:A
本题解析:
本题难度:简单
2、填空题 一定温度下2 L的恒容容器甲中,加入2 mol碳和2 mol CO2发生如下反应: C(s)+CO2(g)  2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
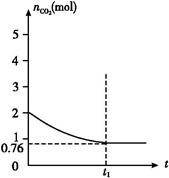
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。?
(2)列式并计算上述温度下此反应的平衡常数 (结果保留一位小数)。?
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填“增大”、“减小”、“不变”或“无法确定”)。?
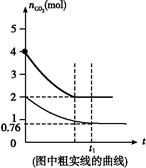
(4)相同温度下,2 L的恒容容器乙中加入4 mol碳和4 mol CO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2 L的恒容容器丙中加入4 mol碳、4 mol CO2和4 mol CO。开始反应时v正 v逆(填“>”、“<”或“=”)。?
参考答案:(1)> 较高
(2)K=c2(CO)/c(CO2)=1.242/0.38≈4.0
(3)减小
(4)
(5)>
本题解析:(1)根据方程式可知,该反应是熵值增加的,由于反应是吸热反应,根据ΔG=ΔH-TΔS,要使该反应自发进行,ΔG<0,则需要在高温下。
(2)平衡时CO2的物质的量是0.76 mol,则消耗CO2是(2-0.76) mol="1.24" mol,所以生成CO是2.48 mol,因此CO2和CO的浓度分别是0.38 mol/L和1.24 mol/L,所以K=c2(CO)/c(CO2)=1.242/0.38≈4.0。
(3)增大CO2的浓度,则平衡向正反应方向移动,但CO2的转化率降低。
(4)由于CO2的浓度增大,所以反应速率加快,达到平衡的时间减少。设消耗CO2 x mol,则生成CO为2x mol,所以有K=c2(CO)/c(CO2)=x2/(2-0.5x)=4.0,解得x="2" mol,据此可画出示意图。
(5)由于此时c2(CO)/c(CO2)=22/2=2<4.0,所以反应向正反应方向移动,则正反应速率大于逆反应速率。
本题难度:一般
3、选择题 在一定温度下,向a L密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g) + 2Y(g) 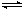 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.正反应和逆反应的速率都为零
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确,A不正确。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,C不能说明。D中反应速率的方向相同,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,因此答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
4、填空题 某温度时在密闭容器中A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。请回答下列问题:
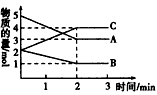
(1)该反应的反应物是_______,生成物是_______。
(2)该反应的化学方程式为________________。
(3)反应开始至2 min时,____(填“能”或“不能”)用物质C表示该反应的反应速率,若能,其反应速率为 _______,若不能,其原因是_________。
(4)2 min后,A、B、C的物质的量不再随时间的变化而变化,说明在这个条件下,该反应__________。
参考答案:(1)A、B;C
(2)2A+B=2C
(3)不能;容器体积未知,无法求出物质C的浓度变化量?
(4)已达化学平衡状态(或达到最大限度)
本题解析:
本题难度:一般
5、计算题 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
物质
| VOSO4
| V2O5
| NH4VO3
| (VO2)2SO4
|
溶解性
| 可溶
| 难溶
| 难溶
| 易溶
|
?
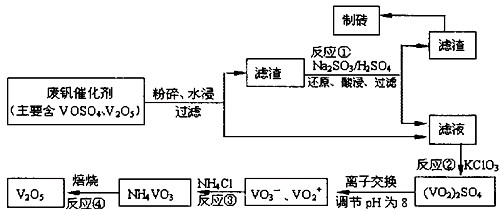
该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为?。
(2)反应①的目的是?。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为?。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是?。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g) 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为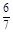 。
。
①该条件下反应2SO2(g)+O2(g) 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;
②下列措施能使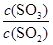 增大的是_____。
增大的是_____。
A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
参考答案:(14分)(1)3V2O5+10Al 6V+5Al2O3(2分);(2)将V2O5转化为可溶的VOSO4(2分)
6V+5Al2O3(2分);(2)将V2O5转化为可溶的VOSO4(2分)
⑶VO2++2OH-=VO3-+H2O(3分) ⑷坩埚(2分); ⑸1620(3分);C(2分)
本题解析:(1)铝是活泼的金属,能和金属氧化物发生铝热反应,所以铝和五氧化二钒发生铝热反应的化学方程式为3V2O5+10Al 6V+5Al2O3。
6V+5Al2O3。
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成可溶性的VOSO4,所以反应①的目的是将V2O5转化为可溶的VOSO4。
(3)VOSO4有强氧化性,能把氯酸钾氧化,自身被还原成(VO2)2SO4。在碱性条件下,VO2+转化为VO3-,反应的离子方程式是VO2++2OH-=VO3-+H2O。
(4)固体加热需要在坩埚中进行,因此必不可少的是坩埚。
(5)①? 2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L)? 1.0? 0.5? 0
转化浓度(mol/L)? 2x? x? 2x
平衡浓度(mol/L)? 1.0-2x? 0.5-x? 2x
一定条件下达到平衡,SO3的体积分数为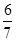
则有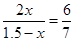
解得x=0.45
所以该温度下可逆反应的平衡常数K=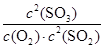 =
=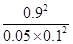 =1620
=1620
②A.正方应是放热反应,则升高温度平衡向逆反应方向移动,因此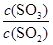 减小;
减小;
B.保持温度和容积不变,再充入2 mol He,反应物和生成物的浓度不变,平衡不移动,因此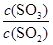 不变;
不变;
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2,相当于是增大压强,平衡向正方应移动,因此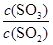 增大;
增大;
D.催化剂只能改变反应速率,但不能改变平衡状态,因此不用V2O5作催化剂,改用其它更高效催化剂使,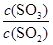 不变,答案选C。
不变,答案选C。
本题难度:一般