| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《离子方程式的书写及正误判断》高频试题巩固(2017年最新版)(八)
参考答案:C 本题解析:A错 Ba2++2OH-+2H+十SO42-=BaSO4↓+2H2O 本题难度:一般 3、填空题 现有四瓶溶液,分别是H2SO4、BaCl2、Na2SO4、Na2CO3中的一种,根据以下实验,请分别确认A、B、C、D各是什么物质? 参考答案:A. H2SO4 B. Na2SO4 C. Na2CO3 D. BaCl2 本题解析:略 本题难度:简单 4、填空题 (12分)食盐是重要调味品,随着对饮食健康的重视,出现了各种类型的特种食盐。 |
参考答案:(共12分)(1)A(2分)
(2)MgSO4 +2NH3·H2O=Mg (OH)2↓+ (NH4) 2SO4或Mg2++2NH3·H2O= Mg (OH)2↓+2NH4+(3分)
(3)硒与氢气化合比硫更难(或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒等)(2分)
(4)5(2分)2IO3-+5SO32-+2H+===I2+5SO42-+H2O(3分)
本题解析:(1)人体吸收的是钙元素的化合物,同时还不能对人体产生危害。A.CaCO3不会对人体产生危害,会与人体内的酸发生反应产生CaCl2,补充钙元素,正确; B.CaO与水发生反应产生Ca(OH)2,对人体产生腐蚀,、危害,不能使用,错误; C.Ca(OH)2溶于水放热,对人体造成伤害,电离产生的OH-也会对人体造成腐蚀,不能使用,错误;D.Ca是很活泼的金属单质,与人体内的水发生反应产生氢气和强碱Ca(OH)2,对人产生一定危害,错误。故选项是A;(2)低钠盐因含有氯化钾和硫酸镁可防治高血压和心血管病,往其溶液中滴入氨水,发生复分解反应产生沉淀。反应的化学方程式是MgSO4 +2NH3·H2O=Mg (OH)2↓+ (NH4) 2SO4或Mg2++2NH3·H2O= Mg (OH)2↓+2NH4+;(3)硒元素、硫元素是同一主族的元素,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,相应的氢化物的稳定性就越强,形成氢化物越容易进行解析比较。所以可以通过硒与氢气化合比硫更难(或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒等)。(4)加碘盐可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变蓝,说明产生了I2,根据元素化合价升高或降低的总数等于原子的原子失去或获得的电子数可知:1mol KIO3被还原时,转移电子5mol,该反应的离子方程式为2IO3-+5SO32-+2H+===I2+5SO42-+H2O。
考点:考查补充钙试剂的选择、离子方程式的书写、元素的非金属性强弱比较的方法、氧化还原反应中的电子转移的知识。
本题难度:一般
5、填空题 (10分)某工厂的工业废水中含有大量的FeSO4,较多的Cu2+和少量Na+。该工厂计划从废水中回收FeSO4和金属铜。根据下列流程图,回答问题。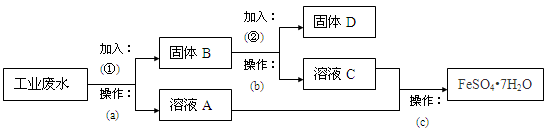
(1)a操作需要用到的玻璃仪器有 。
(2)加入的试剂①为 ,要判断所加试剂①是否过量,其操作方法是 。
(3)加入试剂②发生反应的离子方程式是 。
(4)c操作为 、冷却结晶、 、洗涤、干燥。
参考答案:(1)漏斗、玻璃棒、烧杯 (各1分,共3分)
(2)Fe (1分) 取少量固体B,加入适量稀硫酸溶解,然后取适量上层清液于试管中,滴加少量双氧水,再滴加2-3滴KSCN溶液,溶液变红,说明铁过量(合理即可) (3分)
(3)Fe+2H+=Fe2++H2↑ (1分)
(4)蒸发浓缩 过滤 (各1分,共2分)
本题解析:某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,先加过量铁(①),过滤,得到A溶液为FeSO4,B为Cu和多余的铁,再向B中加过量稀硫酸,过滤得到的D为Cu,C为FeSO4,(1)根据以上分析可知a操作为过滤,所需要用到的玻璃仪器为:漏斗、玻璃棒、烧杯;(2)加入的试剂①为铁粉,要判断所加试剂铁粉是否过量,其操作方法是:取少量固体B,加入适量稀硫酸溶解,然后取适量上层清液于试管中,滴加少量双氧水,再滴加2-3滴KSCN溶液,溶液变红,说明铁过量;(3)加入试剂②为稀硫酸,固体B中只有铁能与之反应,故离子方程式为:Fe+2H+=Fe2++H2↑; (4)操作c是从FeSO4溶液中提取溶质晶体采用蒸发浓缩、冷却结晶 、过滤、洗涤、干燥。
考点:考查物质的性质及实验基本操作。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《离子共存》.. | ||