微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是( )
A.元素的原子序数越大,其原子半径也越大
B.最外层电子数为8的粒子是稀有气体元素的原子
C.在周期表里,主族元素所在的族序数等于原子核外电子数
D.在周期表里,元素所在的同期数等于该元素原子核外电子层数
参考答案:D
本题解析:
本题难度:一般
2、简答题 现有下列短周期元素性质的相关数据:
| ① | ② | ③ | ④ | ⑤ | ⑥
原子半径(10-10m)
1.30
0.82
0.99
1.11
0.90
1.18
|
最高或最低化合价
+2
+3
+7
+4
+2
+3
-1
-4
|
请回答下列问题:
(1)①和③形成的化合物类型为______(填“离子”或“共价”)化合物;
(2)元素①的金属性比元素⑥要______(填“强”或“弱”),试从原子结构方面解释其原因:______;
(3)在自然界中,元素④的存在形态为______,工业上粗制该元素单质的化学方程式为______;
(4)⑥的单质与浓NaOH溶液反应的离子方程式是______;
(5)实验室现有元素①的单质和某未知金属单质M,请简要写出比较两者金属性强弱的一种实验方案______.
参考答案:由同周期元素的原子半径从左向右在减小,同主族元素的原子半径从上到下在增大,再结合短周期元素的最高或最低化合价可知,③为Cl,①为Mg,⑥为Al,④为Si,
(1)①和③形成的化合物为氯化镁,构成微粒为离子,则属于离子化合物,故答案为:离子;
(2)同周期元素的金属性从左向右在减小,则Mg的金属性比铝的强,是因为镁的原子半径大于铝,原子核对最外层电子的吸引力比铝弱,比铝原子更容易失去电子,所以镁元素的金属性比铝要强,故答案为:强;镁的原子半径大于铝,原子核对最外层电子的吸引力比铝弱,比铝原子更容易失去电子,所以镁元素的金属性比铝要强;
(3)在自然界中,Si元素以化合态存在,工业上粗制硅的反应为SiO2+2C?高温?.?Si+2CO↑,
故答案为:化合态;SiO2+2C?高温?.?Si+2CO↑;
(4)Al与NaOH溶液反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)利用不同金属与水或与酸反应,反应剧烈的金属性强,则在两个小烧杯中分别加入适量蒸馏水(或等浓度的盐酸),然后投入形状大小相同的金属片,若M反应比镁剧烈,则M的金属性比Mg强,故答案为:在两个小烧杯中分别加入适量蒸馏水(或等浓度的盐酸),然后投入形状大小相同的金属片,若M反应比镁剧烈,则M的金属性比Mg强.
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素,D的最外层电子数是其内层电子数的三倍.已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的简单离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应.依据上述信息用化学用语回答下列问题:
(1)写出A与C形成化合物的电子式______.
(2)Cm-、E(m-1)-的还原性强弱为______>______,能证明其还原性强弱的离子方程式为______.
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式______.
(4)元素B形成的单质与Fe3O4反应的化学方程式是______.
(5)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:______(写出一种物质的化学式即可,下同),该物质的水溶液显______性,用离子方程式表示其原因:______.
参考答案:A、B、C、D、E是位于短周期的主族元素,D的最外层电子数是其内层电子数的三倍,内层电子数为2,最外层电子数为6,则D为O;由热稳定性为HmD>HmC,则C为S;Cm-、E(m-1)-具有相同的电子层结构,则E的质子数为18-1=17,所以E为Cl;B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小,则B为Al;A、B所形成的简单离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应,则A为
Na,
(1)A与C形成的化合物为Na2S,电子式为
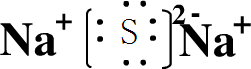
,故答案为:
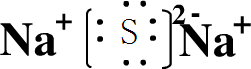
;?
(2)(2)由于非金属性Cl>S,单质的氧化性Cl2>S,单质的氧化性越强,对应阴离子的还原性越弱,则有还原性:S2->Cl-,可通过反应Cl2+S2-=2Cl-+S↓证明,
故答案为:S2-;Cl-;Cl2+S2-=2Cl-+S↓;
(3)Al(OH)3具有两性,与NaOH反应生成AlO2-和H2O,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)Al与四氧化三铁高温下反应生成氧化铝和铁,反应为8Al+3Fe3O4?高温?.?4Al2O3+9Fe,
故答案为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe;
(5)弱酸对应的强碱弱酸盐能水解显碱性,如Na2SO3中水解反应为SO32-+H2O?

?HSO3-+OH-,
NaClO中水解反应为ClO-+H2O?

?HClO+OH-,
弱碱对应的强酸弱碱盐水解显酸性,如Al2(SO4)3中水解反应为Al3++3H2O?

?Al(OH)3+3H+,
故答案为:Na2SO3;碱;SO32-+H2O?

?HSO3-+OH-.
本题解析:
本题难度:一般
4、选择题 下列各组微粒中,电子总数相同的是
[? ]
A.F-,Cl-,Br-,I-
B.S2-,Ca2+,Ar,Cl
C.Na+,K+,Mg2+,Al3+
D.Mg2+,Mg,Al3+,Al
参考答案:B
本题解析:
本题难度:简单
5、简答题 A、B、C、D是四种短周期元素,E、F是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: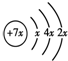 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
(1)A的基态原子的电子排布式是______;
(2)B的最高价氧化物的化学式为______,C的最低负化合价为______.
(3)用轨道表示式表示D原子核外电子排布______;
(4)解释为什么E的外围电子排布式为3d′54s1,而不为3d44s2?______;
(5)F原子结构示意图是______.
参考答案:A、B、C、D是四种短周期元素,A的原子结构示意图为: ,x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E、F是过渡元素,E、F的外围电子排布式分别为3d54s1,3d64s2,故E为Cr元素,F为Fe元素,
,x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E、F是过渡元素,E、F的外围电子排布式分别为3d54s1,3d64s2,故E为Cr元素,F为Fe元素,
(1)A为Si元素,原子核外电子数为14,基态原子的电子排布式是:1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)B为Na元素,最高价氧化物的化学式为:Na2O;C为P元素,最外层电子数为5,最低负化合价为-3,故答案为:Na2O;-3;
(3)D为N元素,原子核外电子数为7,核外电子轨道表示为: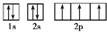 ,故答案为:
,故答案为: ;
;
(4)E的外围电子呈3d′54s1时,3d、4s轨道上的电子处于半满状态,整个体系的能量最低,故么E的外围电子排布式为3d′54s1,而不为3d44s2;
故答案为:E的外围电子呈3d′54s1时,3d、4s轨道上的电子处于半满状态,整个体系的能量最低;
(5)F为Fe元素,是26号元素,Fe原子结构示意图是: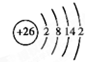 ,故答案为:
,故答案为: .
.
本题解析:
本题难度:一般