|
高中化学知识点总结《物质组成与性质实验方案的设计》高频试题预测(2017年最新版)(十)
2017-03-05 13:29:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 仅由右图装置(夹持和加热装置略去),难以完成的实验是( )
A.由乙酸制备乙酸乙酯
B.由碳制备饱和碳酸氢钠溶液
C.证明氯的非金属性比硫强
D.证明酸性:硫酸>碳酸>硅酸
| 
参考答案:A.乙酸和乙醇可以发生酯化反应,实质是:酸掉羟基醇掉氢,即CH3COOH+C2H5OH浓硫酸
本题解析:
本题难度:简单
2、选择题 下列有关实验的表述中,错误的是(?)
A.除去乙醇的水:加新制生石灰,蒸馏,收集馏出物
B.检验淀粉的水解产物:在用酸作催化剂的水解液中直接加入新制Cu(OH)2溶液,然后加热,观察是否有红色沉淀生成
C.除去乙酸乙酯中的乙酸:加饱和碳酸钠溶液,充分振荡,分液,弃水层
D.银氨溶液的配制:在洁净的试管中加2% AgNO3溶液1~2 mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止
参考答案:B
本题解析:A、生石灰氧化钙极易吸水生成氢氧化钙,因此除去乙醇的水:加新制生石灰,蒸馏,收集馏出物即可,A正确;B、淀粉水解在酸性条件下进行,而醛基与新制氢氧化铜悬浊液的反应是在碱性条件下进行的,故B不正确;C、饱和碳酸钠溶液可以降低乙酸乙酯的溶解度,吸收乙酸,所以除去乙酸乙酯中的乙酸:加饱和碳酸钠溶液,充分振荡,分液,弃水层,C正确;D、在洁净的试管中加2% AgNO3溶液1~2 mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止,此时所得溶液是银氨溶液,D正确,答案选B。
本题难度:一般
3、简答题 金属钠、钙等在氧气中燃烧可生成过氧化物.从组成上分析,过氧化物为金属氧化物,可能会与水、二氧化碳、二氧化硫反应生成盐.
(1)取一支小试管,向其中加入过氧化纳固体,然后加入少量蒸馏水,将带余烬的小木条插入试管中,观察到的现象是______,反应后,向其中滴入酚酞溶液,观察到的现象是______.该反应的化学方程式为______.
(2)有两个实验小组的同学用如图所示的装置进行实验,来探究过氧化钠与二氧化硫的反应
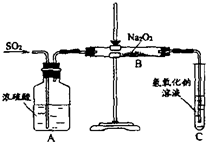
请回答下列问题:
①装置C中氢氧化钠溶液的作用是______
②甲组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:______请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.______
③乙组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?______.请简要说明两点理由:①______;②______.
(3)为了解决养金鱼的吸氧问题,可在水中加入过氧化钙.某过氧化钠样品2.0g,加入到足量的水中,在标准状况下生成了224mL氧气.试计算该样品中含过氧化钙的质量分数.
参考答案:(1)过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;氧气能使带火星的木条复燃;反应后的溶液是氢氧化钠溶液,是碱遇到酚酞变红;
故答案为:有气体放出,小木条复燃,溶液变红,2Na2O2+2H2O=4NaOH+O2↑;
(2)①二氧化硫是污染性气体,装置C中氢氧化钠溶液的作用是吸收二氧化硫气体;
故答案为:吸收二氧化硫气体;
②Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2;验证白色固体是亚硫酸钠的方法利用亚硫酸钠和酸反应生成的二氧化硫具有漂白性检验,实验步骤为:取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体;
故答案为:2Na2O2+2SO2=4Na2SO3+O2↑,取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体.
③在检验硫酸根离子前要排除亚硫酸根离子的干扰,亚硫酸根离子具有还原性,过氧化钠和硝酸都能把亚硫酸根离子氧化生成硫酸根离子,对硫酸根离子造成干扰,所以乙同学的方案不合理,
故答案为:不合理.①稀硝酸能使亚硫酸钡转化为硫酸钡.②若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-.
(3)样品中含过氧化钙的物质的量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
2mol1mol
x0.01mol
x=0.02mol;
CaO2(%)=0.02mol×72g/mol2.0g×100%=72%;
答:该样品中含过氧化钙的质量分数为72%;
本题解析:
本题难度:一般
4、选择题 符合如下实验过程和现象的试剂组是( )
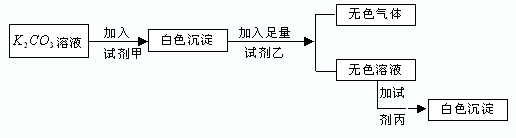
| 甲 | 乙 | 丙
A.MgCl2
HNO3
K2SO4
B.BaCl2
HNO3
K2SO4
C.NaNO3
H2SO4
Ba(NO3)2
D.BaCl2
HCl
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A.碳酸钾与氯化镁反应生成碳酸镁沉淀,加入硝酸反应生成硝酸镁溶液,加入硫酸钾不反应,故A错误;
B.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入硝酸反应生成硝酸钡溶液,加入硫酸钾生成硫酸钡沉淀,故B正确;
C.碳酸钾与硝酸钾不反应,故C错误;
D.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入盐酸反应生成氯化钡溶液,加入氯化钙不反应,故D错误.
故选B.
本题解析:
本题难度:一般
5、填空题 (12分).现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而得到较为纯净的NaNO3。实验流程可用下图表示:
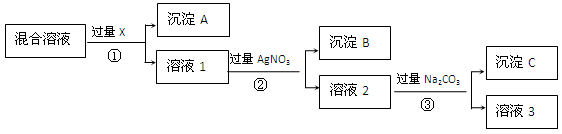
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X:?,沉淀B:?。
(2)实验流程中加入过量的Na2CO3的目的是?。
(3)实验方案得到的溶液3中肯定含有?(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的?,请写出所发生反应的离子方程式_______________。
参考答案:(1) BaCl2或Ba(NO3)2、AgCl (2) 使溶液中的Ag+、Ba2+完全沉淀(3) Na2CO3、稀HNO3、2H++CO32-==H2O+CO2↑
本题解析:略
本题难度:一般
| 