| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《物质组成与性质实验方案的设计》高频试题预测(2017年最新版)(二)
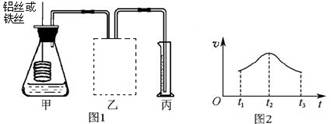 在虚线框内连接合适的装置___________________  ? ?②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量____________________________________。 ③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。 参考答案:(8分) 本题解析:考查弱电解质的电离、条件对反应速率的影响 本题难度:简单 4、实验题 铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
参考答案:(16分)(1)品红试液变浅(或褪色)?(2分) 本题解析:(1)SO2具有漂白性、酸性、还原性和氧化性,读图可知,该实验用品红溶液检验是否有SO2生成,若品红溶液褪色或变浅,说明装置A中反应产生的气体含有SO2;(2)氢气具有强还原性,在加热条件下能使黑色的氧化铜还原为红色的单质铜,H2被氧化为能使白色的无水CuSO4固体变蓝的H2O,若装置E中黑色固体变为红色,F中白色粉末变为蓝色,说明装置A中放出的气体中含有H2;(3)常温下铁被浓硫酸钝化,表面有一层致密氧化物薄膜,加热下强氧化性、强酸性的浓硫酸可以将铁氧化为铁盐,而过量的单质铁可以将铁盐还原为亚铁盐,因此反应后A的溶液中铁元素可能既有Fe2+又有Fe3+,也可能只有Fe3+,还可能只有Fe2+,根据已知假设1、假设2的信息推断假设3为溶液中铁元素只有Fe2+;根据铁及其化合物的性质可知,Fe2+具有还原性,能使酸性KMnO4溶液褪色,Fe3+具有氧化性,能将KI溶液还原为能使淀粉溶液变蓝的I2,Fe2+遇KSCN溶液不变红,而Fe3+遇KSCN溶液变红,大量含有Fe3+的溶液呈黄色,与溴水的颜色相同,由此可以选择适当的试剂设计实验方案验证A的溶液中既有Fe2+又有Fe3+。 本题难度:一般 5、实验题 工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图: 参考答案:(1)2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O (2分) 本题解析:(1)根据流程图信加入NaNO2时有NO生成,发生了氧化还原反应,故其离子方程式2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O。 本题难度:一般 |
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点总结《水的电离平.. | ||