微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( ? )
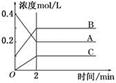
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
参考答案:C
本题解析:A.根据图示可知:A是反应物,B、C是生成物。错误。? B.在前2 min A的分解速率(0.4mol/L -0.2mol/L)÷2min=" 0.1" mol·L-1·min-1.错误。C.在前2 min C的生成速率为(0.2 mol/L- 0mol/L) ÷2min = 0.1mol/(L·min).正确。D.在反应中各种物质的浓度的变化关系是:A:0.2mol/L;B: 0.2mol/L;;C:0.1 mol/L.在相同时间内,物质的浓度变化的比对于方程式该物质前边的计量数的比。所以反应的方程式为:2A(g) 2B(g)+C(g)。错误。
2B(g)+C(g)。错误。
本题难度:一般
2、填空题 在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO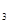 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO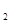 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
参考答案:(5分)(1)固体表面积(2)催化剂(3)物质的性质(4)溶液的浓度(5)温度
本题解析:可以根据影响化学反应速率的因素方面进行分析、判断,从而得出正确的结论。
(1)黄铁矿煅烧时要粉碎成细小的矿粒,可以增大反应物的接触面积,加快反应速率。
(2)熔化的氯酸钾放出气泡很慢,若加入少量Mn02时分解加速,说明化学反应速率受催化剂的影响。
(3)同浓度、同体积的盐酸中放入同样大小的碳粒和镁条,产生气体有快有慢,这说明影响化学反应速率的因素是反应物自身的性质。
(4)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同,这是由于盐酸的浓度不同引起的,反应物的浓度越大,反应速率越快。
(5)夏天的食品易霉变,冬天就不易发生该现象,这是由于夏天气温高,故食品易霉变,而冬天气温低不易发生该现象,因此温度高低对反应速率有影响,温度越高反应速率越快。
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义以及影响因素是答题的关键。因此解答本题时要充分理解影响化学反应速率的因素,然后才能对问题做出正确的判断。
本题难度:一般
3、选择题 反应m A + n B  ?p C中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
?p C中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
A.2:3:1
B.1:3:2
C.2:3:3
D.3:2:1
参考答案:B
本题解析:根据题目可知,A、B、C的反应速率之比为0.5:1.5:1=1:3:2,又化学反应速率之比等于化学方程式中化学计量数之比,所以m:n:p为1:3:2,答案选B。
本题难度:简单
4、选择题 在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是 (?)
2CO(g)反应中可使反应速率增大的措施是 (?)
①缩小容器的体积;②增加碳的量;③通入CO2;④恒压下充入N2?;⑤恒容下充入N2;⑥通入CO
A.①③⑤
B.②④⑥
C.①③⑥
D.③⑤⑥
参考答案:C
本题解析:在C(s)+CO2(g) 2CO(g)反应中要增大反应速率,可以升高温度,可以增大压强,增大浓度(除了固体和纯液体),使用催化剂,增大接触面积等都可以;恒压下充入N2,与反应体系无关,反应速率不变,故选C。
2CO(g)反应中要增大反应速率,可以升高温度,可以增大压强,增大浓度(除了固体和纯液体),使用催化剂,增大接触面积等都可以;恒压下充入N2,与反应体系无关,反应速率不变,故选C。
点评:化学反应速率的影响因素包括以下几点:
内因
1 化学键的强弱与化学反应速率的关系。例如:在相同条件下,氟气与氢气在暗处就能发生爆炸(反应速率非常大);氯气与氢气在光照条件下会发生爆炸(反应速率大);溴气与氢气在加热条件下才能反应(反应速率较大);碘蒸气与氢气在较高温度时才能发生反应,同时生成的碘化氢又分解(反应速率较小)。这与反应物X—X键及生成物H—X键的相对强度大小密切相关。
外因
压强条件
对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞次数增多,反应速率加快;反之则减小。若体积不变,加压(加入不参加此化学反应的气体)反应速率就不变。因为浓度不变,单位体积内活化分子数就不变。但在体积不变的情况下,加入反应物,同样是加压,增加反应物浓度,速率也会增加。若体积可变,恒压(加入不参加此化学反应的气体)反应速率就减小。因为体积增大,反应物的物质的量不变,反应物的浓度减小,单位体积内活化分子数就减小。
温度
只要升高温度,反应物分子获得能量,使一部分原来能量较低分子变成活化分子,增加了活化分子的百分数,使得有效碰撞次数增多,故反应速率加大(主要原因)。当然,由于温度升高,使分子运动速率加快,单位时间内反应物分子碰撞次数增多反应也会相应加快(次要原因)
催化剂
使用正催化剂能够降低反应所需的能量,使更多的反应物分子成为活化分子,大大提高了单位体积内反应物分子的百分数,从而成千上万倍地增大了反应物速率.负催化剂则反之。催化剂只能改变化学反应速率,却改不了化学反应平衡。
浓度
当其它条件一致下,增加反应物浓度就增加了单位体积的活化分子的数目,从而增加有效碰撞,反应速率增加,但活化分子百分数是不变的。
其他因素
增大一定量固体的表面积(如粉碎),可增大反应速率,光照一般也可增大某些反应的速率;此外,超声波、电磁波、溶剂等对反应速率也有影响。
本题难度:简单
5、选择题 向某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+B(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时问的变化如图所示:
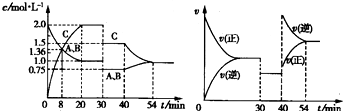
下列说法中正确的是( )
A.30~40?min时间段该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30?min时降低温度,40?min时升高温度
D.8?min前A的平均反应速率为0?08?mol?L-1?min-1?
参考答案:A.由图象可知,30~40?min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,故C错误;
B.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.64mol/L8min=0.08 mol/(L?min),故D正确;
故选D.
本题解析:
本题难度:简单