微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业铝热法炼铁的主要化学反应方程式?。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:①铁锅的腐蚀主要是由?腐蚀造成的。
②铁锅锈蚀的负极反应式为??。
(3)通常使用钢铁是铁和__________的合金;当马口铁(表层镀锡)镀层被损坏后,这时被腐蚀速度比普通铁_______(填“快”或“慢”)。为防止轮船的船体在海水中腐蚀,一般在船身连接?(填“锌块”或“铜块”)
参考答案:(1)2Al+Fe2O3=Al2O3+2Fe
(2)①电化学腐蚀或吸氧腐蚀? ②Fe - 2e →Fe2+
(3)碳?快?锌块
本题解析:(1)铝热法炼铁的化学反应方程式:2Al+Fe2O3=Al2O3+2Fe
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),因此属于吸氧腐蚀。负极反应为:Fe - 2e =Fe2+。
(3)钢铁是铁和碳的合金,马口铁破损后由于锡的活泼性比铁差,因此铁的腐蚀速度比普通铁快,要防止轮船的船体腐蚀,应用锌块来保护铁。
点评:本题比较综合,但是比较基础,难度适中。
本题难度:一般
2、填空题 钢铁吸氧腐蚀正极电极反应式___________________________;钢铁析氢腐蚀正极电极反应式________________________;它们的负极反应是相同的,其电极反应式为_______________________________。
参考答案:2H2O+O2+4e-=4OH-;2H++2e-=H2↑;Fe-2e-=Fe2+
本题解析:
本题难度:一般
3、选择题 Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2 Li+2SO2 Li2S2O4。下列说法正确的是? ( )
Li2S2O4。下列说法正确的是? ( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e-=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
参考答案:C
本题解析:A项,可逆反应要求正逆反应在相同的条件下进行,错;B项,放电时负极产生Li+,Li+向正极移动,错;D项,若换成LiBr的水溶液,则Li会与溶液中的水反应,错。
本题难度:一般
4、选择题 下图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为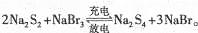 闭合开关K时,b极附近先变红色。下列说法正确的是
闭合开关K时,b极附近先变红色。下列说法正确的是
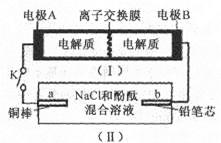
A.当有0.01 mol Na+通过离子交换膜时,b电极上析出112 mL的气体
B.负极反应为3Br--2e-= Br3-
C.闭合K后,b电极附近的pH变小
D.闭合K后.a电极上有氯气产生
参考答案:B
本题解析:A. 在闭合回路中电子转移相同。若有0.01 mol Na+通过离子交换膜时,则外电路转移电子的物质的量也是0.01mol。因为闭合开关K时,b极附近先变红色,说明在b电极为阴极,该电极的电极式为:2H++2e-=H2↑。b电极产生氢气不清楚什么条件,因此无法根据体积确定其物质的量的多少。错误。B是b是阴极,那么B为电源的负极,A为电源的正极。放电时,负极发生的反应为:3Br--2e-= Br3-。正极发生反应:S42-+2e-="2" S22-正确。C.b电极附近溶液变为红色,是因为H+放电使的附近的水的电离平衡被破坏,最终导致附近的c(OH-)增大,pH 增大所以变为红色。错误。D. A为电源的正极,则a是电解池的阳极。因为该电极材料Cu是活性电极,电极本身发生氧化反应Cu-2e-=Cu2+。Cl-不失去电子,所以不会产生氯气。.
本题难度:一般
5、选择题 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是(? )

A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+
参考答案:B
本题解析:液滴边缘O2多,发生正极反应O2+2H2O+4e-=4OH-。液滴下的Fe发生负极反应Fe-2e-=Fe2+,为腐蚀区(a)。A项错误,Cl-由b区向a区迁移;C项错误,液滴下的Fe因发生氧化反应而被腐蚀;D项错误,Cu不如Fe活泼,作正极,负极反应为Fe-2e-=Fe2+。
本题难度:一般