微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 分析下图所示的四个原电池装置,其中结论正确的是? ( )

A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
参考答案:B
本题解析:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故A错误;B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B正确;C、金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故C错误;D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误,故选B。
本题难度:一般
2、选择题 下列有关电化学知识的描述正确的是
[? ]
A.CaO+H2O== Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
参考答案:D
本题解析:
本题难度:一般
3、选择题 茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
[? ]
①铝合金是阳极?②铝合金是负极?③海水是电解质溶液 ?④铝合金电极发生还原反应 ?
A.②③?
B.②③?
C.①③?
D.①④
参考答案:A
本题解析:
本题难度:简单
4、填空题 (7分)如图所示
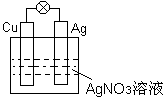
(1)负极材料是 ,
(2)正极的电极反应式为 ,
(3)电池工作时总反应的离子方程式是
(4)电子的流向
(5)阳离子的移动方向___________________________
参考答案:(7分) (1) Cu (1分) (2) Ag+ + e-=Ag (2分)、 (3)Cu+2Ag+=2Ag+Cu2+ (2分)
(4)铜到银(或负极到正极)(1分) (5)向正极(1分)
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。铜比银活泼,所以铜是负极,失去电子。银是正极,溶液中银离子得到电子,被还原而析出。
本题难度:一般
5、选择题 下列各个装置中铁棒被腐蚀由易到难的顺序是正确的是( )
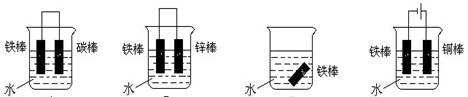
① ② ③ ④
A.③①②④
B.④①③②
C.①③②④
D.②④①③