微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个。请回答下列问题:
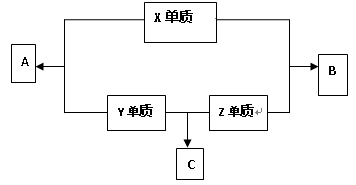
(1)B分子的结构式是??;
(2)X单质与Z单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多
孔性炭制成,通入的气体由孔隙中逸出并在电极表面放电,则正极通入??(填
名称);负极电极反应式为??;
(3)C在一定条件下反应生成A的化学方程式为??。
参考答案:(1)(2分)H-O-H
(2)氧气(1分),H2-2e-+2OH-=2H2O(3分)(若系数不是最简比扣1 分)
(3)(2分)4NH3+5O2? 4NO+6H2O(反应条件写成“一定条件”不扣分)
4NO+6H2O(反应条件写成“一定条件”不扣分)
本题解析:本题属于无机框图题,这种类型的题目关键是找准突破点。常见单质在常温下都是无色气体一般是氢气、氧气和氮气。而H、N、O三种元素的原子序数恰好满足16。它们之间化合的生成物是H2O、NO、NH3。因为一个B分子中含有的Z元素的原子个数比一个C分子中少一个,所以B是H2O,C是NH3,Z元素是氢元素,则X是氧元素,Y是氮元素。
(1)B是水,含有2个H-O键,结构式为H-O-H。
(2)氢气在燃烧时失去电子,被氧化发生氧化反应,所以在燃料电池中正极通入氧气,负极通入氢气,负极电极反应式为H2-2e-+2OH-=2H2O,
(3)氨气中氮元素是-3价,处于最低化合价,可以被氧化生成NO,方程式为4NH3+5O2? 4NO+6H2O
4NO+6H2O
本题难度:一般
2、填空题 (16分)A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为?。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有??。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱, 写出其一级电离方程式:?。
写出其一级电离方程式:?。
②甲在碱性溶液中能够将CuO还原为Cu2O, 已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为?。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX 2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K?(填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=?,YX2的平衡转化率为?。
参考答案:(16分)
(1)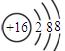 (1分)
(1分)
(2)离子键、共价键(2分)
(3)①N2H4 +H2O N2H5++ OHˉ (2分)
N2H5++ OHˉ (2分)
②N2H4 +4CuO=N2↑+2Cu2O+2H2O?(3分)
(4)2CO(g)+SO2(g)=2CO2(g)+S(s)?ΔH="–268.8" kJ·molˉ1 (3分)
(5)①不变(1分)
②1.6×103 ?80%或0.8(各2分,共4分)
本题解析:略
本题难度:简单
3、推断题 A-G的转化关系如图所示(部分反应物、产物和反应条件未标出)

已知:
①A、B为中学化学常见的金属单质;C-G均为化合物,并且E和G均含有3种元素;
②C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应;
③F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀;
④E和G焰色反应均呈黄色。
根据以上信息回答下列问题:
(1)写出物质G的化学式:_____________。
(2)①-⑥反应中,不属于氧化还原反应的是______________ ;
(3)反应③的离子方程式为_____________ ;
(4)反应⑦对应的总化学方程式为 ________________;
(5)反应③中,若有31.2g C参加反应,转移电子的物质的量为______________ 。
参考答案:(1)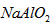
(2)⑥
(3)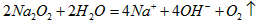
(4)
(5)0.4mol
本题解析:
本题难度:一般
4、填空题 A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
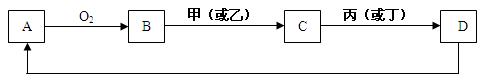
试回答:
(1) 写出B在工业生产中的一种用途?。
(2)写出B转化为C的可能的离子方程式?。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理?。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为?mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式?;若负极材料消耗18g,则电池转移的电子总数为?。?(阿伏加德罗常数用NA表示)
参考答案:(1)工业上制备Al(或作耐火材料)?(1分)
(2)Al2O3+6H+=2Al3++3H2O? Al2O3+2OH—+3H2O = 2[Al(OH)4]— ?或
Al2O3+2OH—=AlO2–+H2O (各2分,共4分)
(3)Al3++3H2O  Al(OH)3(胶体)+3H+?(2分)
Al(OH)3(胶体)+3H+?(2分)
(4)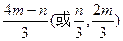 ?(3分)
?(3分)
(5)O2+2H2O+4e—=4OH—? 2NA?(各2分,共4分)
本题解析:略
本题难度:一般
5、选择题 下图各物质是中学化学中常见的物质,甲和A的焰色反应为黄色,常温常压下B为无色无味气体,丁可使带火星的木条复燃。请回答下列问题:
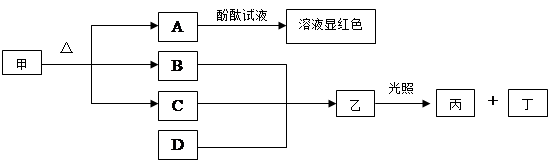
⑴写出B的电子式?。
⑵工业上生产D采用石灰乳与某种气体反应。D常用作?剂
⑶写出由A变甲的化学方程式?。
⑷B与甲烷在一定条件下生成氢气和CO的化学方程式?。
参考答案:(6分)
(1) (1分)
(1分)
(2)漂白或消毒(1分)
(3)CO2+Na2CO3+H2O=2NaHCO3(其他合理答案均给分)
(4)CO2+CH4=2CO+2H2(2分)
本题解析:丁可使带火星的木条复燃,应为O2,结合乙在光照条件下分解的性质可知乙为HClO,丙为HCl,甲和A的焰色反应为黄色,说明都含有Na元素,且A的水溶液呈碱性,可说明甲为NaHCO3,A为Na2CO3,则B为CO2,C为H2O,工业上生产D采用石灰乳与某种气体反应,结合题给转化关系可知D应为Ca(ClO)2,
(1)由以上分析可知B为CO2,电子式为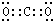 ,故答案为:
,故答案为: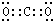 ;
;
(2)D为Ca(ClO)2,具有氧化性,可与酸反应生成具有漂白性的次氯酸,常用于漂白或消毒,
故答案为:漂白或消毒;
(3)Na2CO3可与CO2和水反应生成NaHCO3,反应的方程式为CO2+Na2CO3+H2O=2NaHCO3,
故答案为:CO2+Na2CO3+H2O=2NaHCO3;
(4)CO2与甲烷在一定条件下生成氢气和CO,二者发生氧化还原反应,反应的方程式为CO2+CH4=2CO+2H2,
故答案为:CO2+CH4=2CO+2H2.
本题难度:一般