微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐.下列说法不正确的是( )
A
BCDEF.
A.当X是强酸时,ABCDEF均含有同一种元素,F是硫酸
B.当X是强碱时,ABCDEF均含有同一种元素,F是硝酸
C.B和Cl2的反应一定是氧化还原反应
D.当X是强酸时,C常温下是气态单质
参考答案:D
本题解析:
本题难度:简单
2、填空题 (10分) A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100ml 2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构最外层电子数是次外层电子数的三倍。根据上述条件,回答:
(1)元素C位于第_____周期第_____族,它的最高价氧化物的化学式为_____?_。?
(2)A是元素______?___,B是元素______?___,D是元素_______?_____。
(3)A与D形成稳定化合物的化学式为_____________,判断该化合物在空气是否变质的简易方法是______?_________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液来吸收,其离子方程式为_____________?______________。?
参考答案:(1)3;ⅦA;Cl2O7。(2)Na;Mg;O。
(3)Na2O2;观察该化合物的颜色是否变白。(4)Cl2+2OH—=Cl—+ClO—+H2O
本题解析:根据元素的结构及有关性质可知, A、B、C、D四种元素分步是Na、Mg、Cl、O。
(1)氯元素的原子序数是17,所以位于第三周期第ⅦA;氯元素的最高价是+7价,所以最高价氧化物是Cl2O7。
(2)略
(3)钠和氧形成的稳定化合物是过氧化钠,化学式为Na2O2;过氧化钠是淡黄色的,变质后变成白色,据此可以鉴别,即观察该化合物的颜色是否变白。
(4)氯气有毒,可用氢氧化钠溶液吸收,方程式为Cl2+2OH—=Cl—+ClO—+H2O。
本题难度:一般
3、推断题 已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
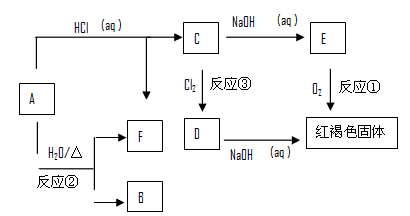
请根据以上信息回答下列问题:
(1)写出物质B的化学式:_______、C的化学式_______、D的化学式_______、E的化学式________
(2)写出下列反应的化学方程式(如果是氧化还原反应请标出单线桥)
反应①________________________
反应②________________________
反应③________________________
参考答案:(1)Fe3O4;FeCl2;FeCl3;Fe(OH)2
(2)反应①:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
反应②:3Fe + 4H2O(g) === Fe3O4 + 4H2
反应③:“略”
本题解析:
本题难度:一般
4、填空题 下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为?(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为?>?。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式?。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式?。
②写出检验A溶液中溶质的阴离子的方法:?。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为?mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有?。
参考答案:(1)Na>Cl>F
(2)HClO4 H2SO4
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
②取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成
③0.01
④Al(OH)3、H2O、NaCl
本题解析:根据元素在周期表中的位置可以确定各元素。
(1)由元素周期表中原子半径递变规律可知,原子半径Na>Cl>F。
(2)非金属性S<Cl,故酸性H2SO4<HClO4。
(3)H、O按1∶1组成H2O2,可氧化Fe2+:H2O2+2Fe2++2H+=2Fe3++2H2O
(4)黄绿色气体B为Cl2,由图中转化关系可知A为NaCl,C为H2,D为NaOH,由D(NaOH)可以和G反应生成C(H2)可知,G为Al。
①2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
②检验Cl-应取少量试液,滴加硝酸酸化的硝酸银溶液。
③2NaCl+2H2O 2NaOH+H2↑+Cl2↑,产生OH-的物质的量为:0.01 mol/L×1 L=0.01 mol,每生成1 mol NaOH转移1 mol电子。故转移电子为0.01 mol。
2NaOH+H2↑+Cl2↑,产生OH-的物质的量为:0.01 mol/L×1 L=0.01 mol,每生成1 mol NaOH转移1 mol电子。故转移电子为0.01 mol。
④由各步反应恰好完全转化可知HCl和NaAlO2溶液等物质的量混合,发生反应:HCl+NaAlO2+H2O=Al(OH)3↓+NaCl。
本题难度:简单
5、填空题 (每空2分,共14分)A、B、C、D、E、F六种中学化学中常见的物质,有如图转化关系,则:
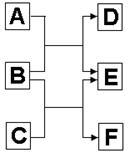
(1)若A、C、E皆为氧化物,且E为有毒气体,B、D、F皆为非金属单质,且D为气体。则A的结构简式为?,单质F的晶体类型为?,1molC中含有?个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体,F遇空气变为红棕色则。?
①A、C、E沸点由高到低的顺序为?,(填化学式);A、C、E三种气态氢化物稳定性最强的是?(填化学式)。
②B跟C反应生成E和F的化学方程式为?。
③A跟D常温下反应可生成一种单质,化学方程式为?。
参考答案:(每空2分,共14分)(1)H-O-H,原子晶体,4NA;(2)①H2O>NH3>H2S,H2O;
②4NH3 + 5O2?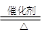 ?4NO +6 H2O,?③SO2 + 2H2S=2H2O + 3S↓
?4NO +6 H2O,?③SO2 + 2H2S=2H2O + 3S↓
本题解析:(1)根据题意反应都是置换反应,由于E为有毒气体,所以E水CO,则A是水,B是碳,C是二氧化硅,D是氧气,F是硅。在二氧化硅晶体,每个硅原子形成4个硅氧键,所以1mol二氧化硅中含有4NA个共价键。
(2)D、F为有毒气体,F遇空气变为红棕色,则F是NO,C是氨气,B是氧气,E是水,A是硫化氢,D是SO2。
①水分子间、氨气分子间都存在氢键所以沸点都高于硫化氢的,即H2O>NH3>H2S。非金属性越强,氢化物的稳定性越强,水最稳定。
②该反应是氨的催化氧化,方程式为4NH3 + 5O2?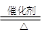 ?4NO +6 H2O。
?4NO +6 H2O。
③SO2具有氧化性,能和氧化硫化氢生成单质硫和水,方程式为SO2 + 2H2S=2H2O + 3S↓。
本题难度:一般