微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于热化学方程式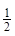 H2(g)+
H2(g)+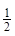 I2(g)=HI(g)? △H=-4.5 kJ?mol-1的叙述正确的是( ?)
I2(g)=HI(g)? △H=-4.5 kJ?mol-1的叙述正确的是( ?)
A.1mol H2和1mol I2完全反应放出4.5kJ热量
B.1个氢分子和1个碘分子完全反应放出9kJ热量
C.1mol H2和1mol I2完全反应生成气态HI放出9kJ热量
D.0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量
参考答案:C
本题解析:根据热化学方程式的含义可知,该热化学方程式表示的意义是1mol H2和1mol I2完全反应生成气态HI放出9kJ热量,选项C正确,其余选项都是正确的,答案选C。
点评:该题是常识性知识的考查,难度不大。主要是考查学生对热化学方程式含义以及表示的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
2、选择题 15.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)?△H= +64.39kJ·mol-1
②2H2O2(l)=2H2O (l)+O2(g)?△H= -196.46kJ·mol-1
(l)+O2(g)?△H= -196.46kJ·mol-1
③H2(g)+O2(g)=H2O(l)?△H= -285.84kJ·mol-1?
下列有关说法错误的是(? )
A.铜可以溶解于稀盐酸与H2O2的混合溶液
B.铜溶解于酸性双氧水的热化学方程式为:
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68 kJ·mol- 1
1
C.反应①是在任何条件下都不可能发生的化学反应
D.用H2O2和H2SO4的混合溶液溶解铜比用浓硫酸溶解铜环保
参考答案:C
本题解析:略
本题难度:简单
3、选择题 已知25℃、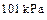 时:
时:
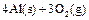

 ;
;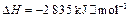
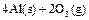

 ;
;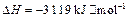
下列说法正确的是(?)
A.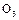 比
比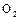 稳定,由
稳定,由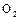 转化为
转化为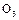 是吸热反应
是吸热反应
B.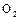 比
比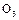 稳定,由
稳定,由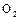 转化为
转化为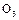 是放热反应
是放热反应
C.等质量的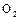 比
比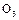 能量高,由
能量高,由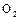 转化为
转化为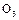 是放热反应
是放热反应
D.等质量的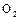 比
比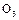 能量低,由
能量低,由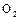 转化为
转化为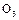 是吸热反应
是吸热反应
参考答案:D
本题解析:略
本题难度:一般
4、填空题 (6分)氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g)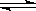 N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+ 3H2(g)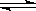 2NH3(g)的K=?(填数值)。
2NH3(g)的K=?(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正?V(NH3)逆(填:>、<、=、不能确定)。
(2)已知: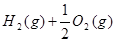 =H2O(l)?△H=—285.8 kJ·
=H2O(l)?△H=—285.8 kJ· ?…①
?…①
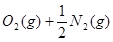 ?=NO2(g)?△H=+33.9 kJ·
?=NO2(g)?△H=+33.9 kJ· ?…②?
?…②?
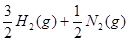 ?=NH3(g)?△H=—46.0 kJ·
?=NH3(g)?△H=—46.0 kJ· ?…③
?…③
H2O(l)=H2O(g)?△H=+44 kJ· ?…④
?…④
则表示NH3燃烧热的热化学方程式为?
参考答案:(1)①? 1/2?;②?=
(2)NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol
本题解析:(1)①根据平衡常数的表达式可知,逆反应的平衡常数是正反应的平衡常数的倒数,因此K=0.5。
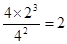 ②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以?,因此正逆反应速率相等。
②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以?,因此正逆反应速率相等。
(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据盖斯定律可知,①×3/2-③即得到NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l),所以反应热是—285.8 kJ· ×1.5+46.0 kJ·
×1.5+46.0 kJ· =-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
=-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
本题难度:一般
5、选择题 关于下图,下列说法不正确的是
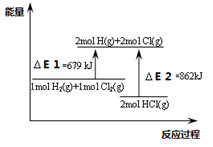
A.△E1是该反应的活化能
B.△E2是2mol HCl(g)的总键能
C.该反应的热化学方程式为:H2(g)+Cl2(g)=2 HCl(g) △H=-183KJ/mol
D.该反应是一个吸热反应
参考答案:D
本题解析:D不正解,由图可知,反应物的总能量大于生成物的总量,该反应为放热反应;
本题难度:一般