|
高考化学必考知识点《盐类水解的原理》考点强化练习(2017年押题版)(十)
2017-03-05 13:38:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存
B.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
C.一定温度下。l L 0.5 mol·L-1NH4C1溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量相同
D.反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS)
|
参考答案:D
本题解析:A、常温下水电离出c(H+)×c(OH-)=10-20的溶液,说明溶液可能是酸性也可能是碱性,ClO-在酸性条件和H+反应生成弱酸HClO不共存,NH4+在碱性条件:NH4++OH-=NH3·H2O不共存,错误;B、在离子组中,Fe3+不能在pH=7溶液中存在,转变成Fe(OH)3,错误;C、NH4Cl是强酸弱碱盐,NH4+水解:NH4++H2O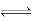 NH3·H2O+H+,浓度越小,越促进水解,0.5mol·L-1NH4Cl中c(NH4+)最大,错误;D、Ksp的应用,同一类型的Ksp越小,说明该物质越难溶,同时反应向着更难溶的方向进行,Ksp(ZnS)>Ksp(CuS),正确。 NH3·H2O+H+,浓度越小,越促进水解,0.5mol·L-1NH4Cl中c(NH4+)最大,错误;D、Ksp的应用,同一类型的Ksp越小,说明该物质越难溶,同时反应向着更难溶的方向进行,Ksp(ZnS)>Ksp(CuS),正确。
考点:考查盐类水解、溶度积、影响水电离的因素等相关知识。
本题难度:一般
2、选择题 A+、B+、C+、D-四种离子两两组成四种可溶性盐,其中:AC和BD盐溶液PH=7,BC盐溶液PH>7,则下列说法正确的是
A.AD盐溶液PH<7
B.在AC盐溶液中C(A+)+C(AOH)=C(C-)+C(HC)
C.碱的电离程度一定是:AOH>BOH
D.酸的电离程度一定是:HD>HC
参考答案:C
本题解析:
本题难度:困难
3、填空题 (每空2分,共12分)
I、(1)已知1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,请写出H2S气体燃烧热的热化学方程式:
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为: K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O ②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
参考答案:24、I(1)H2S(g)+ 3/2O2(g)=SO2(g)+H2O(l) ΔH="-586.16" kJ·mol-1
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O (g) ?H="-641.63" KJ/mol II (1)③>②>① (2)>
Ⅲ(1)Al(OH)3 (2)不含有
本题解析:Ⅰ、1 g H2S完全燃烧,放出17.24 kJ的热量,则H2S的燃烧热为:17.24 kJ·g-1×34 g·mol-1="586.16" kJ·mol-1,则H2S燃烧的热化学方程式为H2S(g)+ 3/2O2(g)=SO2(g)+H2O(l) ΔH="-586.16" kJ·mol-1。
(2)0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O (g) ?H="-641.63" KJ/mol
Ⅱ、(1)酸碱抑制水的电离,则氨水中水的电离程度最小,KHSO3溶液显酸性,电离程度大于水解程度,仍对水的电离起抑制作用,但不如氨水抑制的厉害,KHCO3溶液显碱性,对水的电离起促进作用,则溶液中水的电离程度由大到小的排列顺序为③>②>①,(2)根据c(H2SO3 )<c(SO32-)可知在KHSO3溶液中,HSO3-离子的电离程度大于水解程度,所以0.1 mol·L-1的NaHSO3溶液中C(H+)>C(OH-)。
Ⅲ、(1)根据Al(OH)3、Cu(OH)2的溶度积常数,在浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,要使Al3+沉积,需符合[Al3+][OH-]3=1.1×10-33,[OH-]=2.22×10-11, 要使Cu2+沉积,需符合[Cu2+][OH-]2=2.2×10-20,[OH-]=1.48×10-10,所以Al(OH)3先沉积,(2)铁离子完全沉淀时,[OH-]3=(4.0×10-38)÷(1.0×10-5)=4.0×10-33,则c(Al3+)·c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有Al(OH)3沉淀。
考点:考查热化学方程式的书写,影响水电离平衡的因素,难溶电解质的沉淀溶解平衡等知识。
本题难度:困难
4、选择题 把溶液AlCl3与NaHCO3溶液分别蒸干灼烧,最后得到的固体产物分别为
A:AlCl3、NaHCO3 B:Al(OH)3、NaHCO3 C:Al2O3、NaOH D:Al2O3、Na2CO3
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水 氢氧化钠(填“<” 、“="”" 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性, 消耗的盐酸多。反应生成的氯化铵溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式和简要文字表达)
参考答案:(1)①< ② NaOH 酸性 NH4++H2O NH3.H2O+H+ ③ b a NH3.H2O+H+ ③ b a
(2)白色沉淀转变为红褐色 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ ,相同条件下Fe(OH)3 溶解度小于 Mg(OH)2溶解度 ,使 Mg(OH)2溶解平衡移动,生成更难溶Fe(OH)3。
本题解析:(1)氨水是弱碱,氢氧化钠是强碱,在浓度相等的条件下,氨水的碱性弱于氢氧化钠的。和盐酸恰好反应后生成的氯化铵水解显酸性,而氯化钠不水解,显中性。溶液的pH=7,则c(OH—) =c(H+),根据电荷守恒c(NH4+)+ c(H+)= c(Cl—)+c(OH—)可知c(NH4+) = c(Cl—),即选项b正确。若溶液的pH>7,则c(OH—) >c(H+),选项a正确。
(2)因为氢氧化镁的溶解度大于氢氧化铁的,根据沉淀转化的原理可知,氢氧化镁将转化为更难溶的氢氧化铁。
本题难度:困难
|