微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知氧化性:Cl2>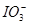 >Fe3+>I2,以下实验的结论或实验的预测合理的是
>Fe3+>I2,以下实验的结论或实验的预测合理的是
A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I-
B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色
C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有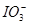
D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成
参考答案:C
本题解析:A项中过量氯水将I-氧化为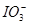 ,错误;B项中FeCl2与碘水不反应,错误;
,错误;B项中FeCl2与碘水不反应,错误;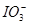 可将I-氧化为I2,C项正确;D项中氯水先将I-氧化为I2,其水溶液为棕黄色,错误。
可将I-氧化为I2,C项正确;D项中氯水先将I-氧化为I2,其水溶液为棕黄色,错误。
本题难度:一般
2、填空题 (8分)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,??是氧化剂;?是还原剂;?元素被氧化;?元素被还原;?是氧化产物;??是还原产物;1mol K2Cr2O7反应时转移电子为?mol.
参考答案:(最后一空2分,其余每空1分,共8分)
K2Cr2O7?HCl? Cl? Cr? Cl2?CrCl3?6mol
本题解析:根据方程式可知,铬元素的化合价从+6价降低到+3价,得到3个电子。氯元素的化合价从-1价升高到0价,失去1个电子。所以K2Cr2O7是氧化剂,HCl是还原剂。Cl元素被氧化,Cr被还原。氯气是氧化产物,CrCl3是还原产物。根据化合价的变化可知,1mol K2Cr2O7反应时转移电子为2mol。
点评:判断氧化还原反应是最关键的是准确判断出有关元素的化合价变化情况,然后根据相应的概念判断即可。而在氧化还原反应的计算中,电子得失守恒是经常用到的关系式。
本题难度:简单
3、选择题 在室温下,发生下列几种反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,判断下列结论错误的是? ( )
A.溶液中可发生:Z2+2A2+===2A3++2Z-
B.Z2在①、③反应中作还原剂
C.氧化性强弱的顺序为:XO4->Z2>B2>A3+
D.X2+是XO4-的还原产物
参考答案:B
本题解析:根据反应②③可知,Z2的氧化性强于A3+的,所以选项A正确;根据氧化剂的氧化性强于氧化产物的可知,选项C正确;同样选项D中XO4-是氧化剂,所以Z2在①中是氧化产物,所以X2+是还原产物;在③中是氧化剂,B不正确,答案选B。
本题难度:简单
4、选择题 水在下列化学反应中,作还原剂的是( ?)
A.2F2+2H2O=4HF+O2
B.Cl2+H2O=HCl+HClO
C.Na2O+H2O=2NaOH
D.2Na+2H2O=2NaOH+H2↑
参考答案:A
本题解析:还原剂在化学反应中失去电子化合价升高,据此可以判断H2O在化学反应中的作用。
本题难度:简单
5、选择题 下列的氧化还原反应中,水既不是氧化剂也不是还原剂的是
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HclO
参考答案:D
本题解析:略
本题难度:简单