微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列金属元素的单质中还原性最强的是
A.K
B.Na
C.Al
D.Mg
参考答案:A
本题解析:根据元素周期律可知,金属钾的还原性最强。答案选A。
本题难度:困难
2、选择题 下列关于碳酸钠溶液与碳酸氢钠溶液的叙述不正确的是
A.分别滴加澄清石灰水,能生成沉淀的是碳酸钠溶液
B.分别滴加氯化钙溶液,能生成沉淀的是碳酸钠溶液
C.等物质的量浓度的两种溶液,碳酸钠溶液的pH大
D.等物质的量浓度的两种溶液,分别滴加稀盐酸,碳酸氢钠溶液反应的剧烈
参考答案:A
本题解析:
本题难度:困难
3、选择题 下列各组物质中,都是由极性键构成的非极性分子的一组是
A.CO2和H2O
B.CO2和Cl2
C.NH3和H2O
D.CH4和CO2
参考答案:D
本题解析:不同种非金属元素之间形成极性键,具有对称结构的为非极性分子。
本题难度:简单
4、选择题 把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是
A.A
B.B
C.C
D.D
参考答案:AD
本题解析:分析:第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 ;②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据二氧化碳是否过量用讨论的方法计算.
解答:2.24L混合气体的物质的量为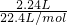 =0.1mol;
=0.1mol;
2.016LO2的物质的量为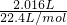 =0.09mol.
=0.09mol.
2Na2O2+2CO2=2Na2CO3+O2 △n
2 2 1
n m 0.1mol-0.09mol=0.01mol
n=m=0.02mol,
(1)若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2 Na2O2+4 HCl=4NaCl+2H2O+O2
0.16mol 0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol 0.02mol
所以Na2O2为0.16mol,NaHCO3为0.02mol;混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
消耗的HCl为0.32mol+0.02mol=0.34mol,物质的量浓度为 =3.4mol/L.
=3.4mol/L.
(2)若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol-0.01mol=0.09mol.
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol 0.09mol
所以Na2O2为0.02mol,NaHCO3为0.09mol;混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
消耗的HCl为 0.04mol+0.09mol=0.13mol,物质的量浓度为 =1.3mol/L.
=1.3mol/L.
故选AD.
点评:本题考查化合物的计算,题目难度中等,注意利用端值法结合相关反应的方程式计算该题.
本题难度:困难
5、选择题 有X、Y、Z、W四种含氧酸,其成酸元素均为元素周期表中的短周期元素.将分别含有一定质量的X、Y、Z、W的水溶液进行光照或微热(有关的反应均进行完全),测得的数据如下表:
A.表中的数据a=5.1g
B.含氧酸Y为硫酸
C.四种含氧酸的成酸元素的化合价分别为+4、+5
D.四种含氧酸中有一种是强电解质、三种是弱电解质
参考答案:D
本题解析:分析:常见的含氧酸中,见光易分解的有硝酸、碳酸、亚硫酸、次氯酸,再据质量守恒定律即可推断
解答:在常见含氧酸中,见光易分解的有硝酸、碳酸、亚硫酸、次氯酸,分解产物有三种的是硝酸,据此可以确定X为HNO3,根据产物间质量关系可确定U为O2,V为H2O,Q为NO2;由质量守恒可知a=0.9g+3.2g=4.1g,b=3.1g-0.9g=2.2g,c=10.5g-3.2g=7.3g,并由此可以确定Y为H2SO3,Z为H2CO3,W为HClO,所以选项D正确,A、B、C不正确;故选D.
答案:D
点评:本题考查含氧酸的性质及质量守恒定律,要明确酸分解的产物种类及质量关系,难度较小.
本题难度:困难