微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (3分)实验室配置硫酸铝溶液时常滴入少量稀硫酸,解释:______。
参考答案:

本题解析:略
本题难度:简单
2、选择题 常温下PH=2的A酸溶液和PH=12的B碱溶液等体积混合后,溶液的PH一定小于7,则A、B可能为(? )
A.强酸、强碱? B.弱酸、弱碱? C.强酸、弱碱? D.弱酸、强碱?
参考答案:D
本题解析:若为强酸、强碱,则混合后溶液的PH应=7;
要求混合后溶液的PH小于7,则余酸,所以:A、B可能为弱酸、强碱
本题难度:一般
3、选择题 下列说法正确的是
A.酸性溶液中水的电离程度一定比纯水的电离程度小
B.室温下:pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7
C.HA的酸性比HB的强,则Na A溶液的pH一定比NaB溶液的小
D.0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)> c(SO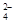 ) >c(HCO
) >c(HCO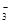 )> c(OH-)> c(H+)
)> c(OH-)> c(H+)
参考答案:D
本题解析:酸性溶液可以是酸溶液,也可以是盐类水解而成的酸性溶液,在酸溶液中抵制水的电离,而盐类水解而成的酸性溶液水的电离程度比纯水的电离程度小,A错;pH=3的醋酸和pH=11的NaOH溶液等体积混合后溶液中溶质的成分为醋酸、醋酸钠,溶液显酸性,B错;HA的酸性比HB的强,则同浓度的Na A溶液的pH一定比NaB溶液的小,如果离开了同浓度的前提则不一定,C错。0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合后,溶液中溶质成分为NaHCO3、Na2SO4,所以D正确。
本题难度:一般
4、选择题 对0.2mol·L-1碳酸钠溶液的微粒浓度分析正确的是?
A.[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]
B.[Na+]+[H+]=[CO32-]+[HCO3-]+[OH-]
C.[OH-]=[H+]+[HCO3-]+[H2CO3]
D.[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1
参考答案:A、D
本题解析:碳酸钠为强减弱酸盐,其溶液发生如下电离和水解过程:
Na2CO3====2Na++CO32-
CO32-+H2O HCO3-+OH-
HCO3-+OH-
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
故溶液中存在的微粒有Na+、H+、OH-、CO32-、HCO3-、H2CO3等,它们的浓度关系:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]。按电荷守恒分析其浓度关系:
[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
按物料守恒分析其浓度关系:
[Na+]=[CO32-]+[HCO3-]+[H2CO3]
∵[Na+]=0.2mol·L-1,?∴[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1。
本题难度:一般
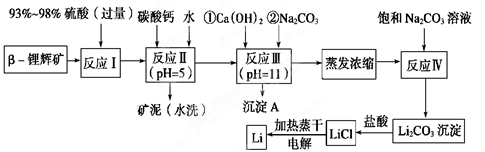
5、填空题 锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物
| Fe(OH)3
| Al(OH)3
| Mg(OH)2
|
开始沉淀pH
| 2.7
| 3.7
| 9.6
|
完全沉淀pH
| 3.7
| 4.7
| 11
|
?
②Li2CO3在不同温度下的溶解度如下表:
温度/℃
| 0
| 10
| 20
| 50
| 75
| 100
|
Li2CO3的溶解度/g
| 1.539
| 1.406
| 1.329
| 1.181
| 0.866
| 0.728
|
?
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。
参考答案:
(1)Li2O?Al2O3?4SiO2 ?
(2)除去反应Ⅰ中过量的H2SO4;控制pH,使Fe 3+、A l 3+完全沉淀
(3)Mg2++2OH-=Mg(OH)2↓、Ca 2++CO32-=CaCO3↓
(4)过滤 热水 Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2
本题解析:(1)硅酸盐既可以用盐的形式表示母液可以用氧化物的形式表示。在用氧化物形式表示时要符合质量守恒定律。且一般情况下,金属氧化物写在前面,非金属氧化物写在后面。LiAlSi2O6的氧化物的形式表示为Li2O?Al2O3?4SiO2?。(2)反应Ⅱ加入碳酸钙是为了除去反应Ⅰ中过量的H2SO4;控制pH,使Fe 3+、A l 3+完全沉淀。(3)根据框图中物质之间的转化关系可知反应Ⅲ中生成沉淀A的离子方程式为Mg2++2OH-=Mg(OH)2↓、Ca 2++CO32-=CaCO3↓。(4)反应Ⅳ中由于Li2CO3溶解度小,所以生成Li2CO3沉淀,在实验室中从溶液中分离得到Li2CO3沉淀的操作是过滤。因为Li2CO3的溶解度随温度的升高而降低,所以洗涤所得Li2CO3沉淀要使用热水。(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气是因为在加热蒸干LiCl溶液时,LiCl有少量发生水解反应生成LiOH,它受热分解生成Li2O,电解时产生O2。因此制取的氯气中常含有少量的O2。
本题难度:一般